فوسفات البوتاسيوم
فوسفات البوتاسيوم مركب كيميائي لاعضوي يتألف من عناصر الفوسفور والأكسجين والبوتاسيوم، وله الصيغة K3PO4، ويوجد على شكل مسحوق بلوري أبيض، ويوجد غالباً متبلوراً مع الماء، إما على شكل ثلاثي أو سباعي أو تساعي هيدرات.[2]
| فوسفات البوتاسيوم | |
|---|---|
 فوسفات البوتاسيوم | |
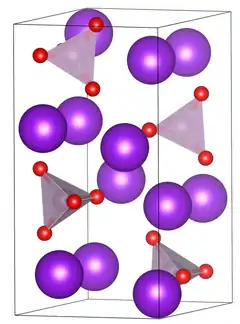 Unit cell of the anhydrous tripotassium phosphate under standard conditions (low temperature modification). Unit cell of tripotassium phosphate. | |
| الاسم النظامي (IUPAC) | |
Potassium phosphate | |
| تسمية الاتحاد الدولي للكيمياء | |
Potassium tetraoxidophosphate(3−) | |
| المعرفات | |
| CAS | 7778-53-2 |
| بوب كيم | 62657 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| الخواص | |
| الصيغة الجزيئية | K3PO4 |
| الكتلة المولية | 212.27 غ/مول |
| المظهر | مسحوق بلوري أبيض متسيّل |
| الكثافة | 2.56 غ/سم3 |
| نقطة الانصهار | 1340 °س |
| الذوبانية في الماء | 508 غ/ل ماء |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
الخواص
يوجد المركب في الشروط القياسية على شكل مسحوق بلوري أبيض اللون، وهو يتسيّل بسهوله لامتصاصه الماء؛ كما يذوب بشكل جيد في الماء. للمركب صفات قاعدية قوية.
الاستخدامات
يستخدم فوسفات البوتاسيوم في المجال البحثي العلمي حفازاً لبعض تفاعلات الاصطناع العضوي.[4][5][6][7]
مراجع
- معرف بوب كيم: https://pubchem.ncbi.nlm.nih.gov/compound/62657 — تاريخ الاطلاع: 19 نوفمبر 2016 — العنوان : Potassium phosphate — الرخصة: محتوى حر
- Klaus Schrödter; Gerhard Bettermann; Thomas Staffel; Friedrich Wahl; Thomas Klein; Thomas Hofmann (2005), "Phosphoric Acid and Phosphates", موسوعة أولمان للكيمياء الصناعية, فاينهايم: وايلي-في سي إتش, doi:10.1002/14356007.a19_465.pub3 الوسيط
|CitationClass=تم تجاهله (مساعدة); الوسيط|separator=تم تجاهله (مساعدة)CS1 maint: ref=harv (link) - Cyclic process for producing tripotassium phosphate and ammonium chloride, 1968-10-15, مؤرشف من الأصل في 6 يونيو 2019, اطلع عليه بتاريخ 27 أبريل 2018 الوسيط
|CitationClass=تم تجاهله (مساعدة); الوسيط|separator=تم تجاهله (مساعدة)CS1 maint: ref=harv (link) - Dandepally, Srinivasa Reddy; Williams, Alfred L. (2009-03-04). "Microwave-assisted N-Boc deprotection under mild basic conditions using K3PO4·H2O in MeOH". Tetrahedron Letters (باللغة الإنجليزية). 50 (9): 1071–1074. doi:10.1016/j.tetlet.2008.12.074. ISSN 0040-4039. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Xu, Hui; Chen, Yang (2007-04-30). "C(aryl)-O Bond Formation from Aryl Methanesulfonates via Consecutive Deprotection and SNAr Reactions with Aryl Halides in an Ionic Liquid". Molecules (باللغة الإنجليزية). 12 (4): 861–867. doi:10.3390/12040861. PMC 6149384. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Shirakawa, Eiji; Kitabata, Takaaki; Otsuka, Hidehito; Tsuchimoto, Teruhisa (2005-10-10). "A simple catalyst system for the palladium-catalyzed coupling of aryl halides with terminal alkynes". Tetrahedron (باللغة الإنجليزية). 61 (41): 9878–9885. doi:10.1016/j.tet.2005.07.099. ISSN 0040-4020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Niu, Jiajia; Zhou, Hua; Li, Zhigang; Xu, Jingwei; Hu, Shaojing (2008-10-03). "An Efficient Ullmann-Type C−O Bond Formation Catalyzed by an Air-Stable Copper(I)−Bipyridyl Complex". The Journal of Organic Chemistry (باللغة الإنجليزية). 73 (19): 7814–7817. doi:10.1021/jo801002c. ISSN 0022-3263. PMID 18771324. الوسيط
|CitationClass=تم تجاهله (مساعدة)
- بوابة الكيمياء
فوسفات البوتاسيوم في المشاريع الشقيقة
 صور وملفات صوتية من كومنز
صور وملفات صوتية من كومنز
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.
