فري أكسالات البوتاسيوم
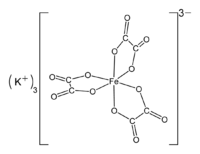
فرّي أكسالات البوتاسيوم (ملاحظة 1) مركب كيميائي صيغته [K3[Fe(C2O4)3، كما يمكن أن يكون بالشكل المميّه ثلاثي الهيدرات ؛ ويوجد على شكل بلورات زمردية خضراء.
| فرّي أكسالات البوتاسيوم | |
|---|---|
 فري أكسالات البوتاسيوم | |
 فري أكسالات البوتاسيوم | |
| الاسم النظامي (IUPAC) | |
Potassium iron(III) oxalate | |
| المعرفات | |
| CAS | 14883-34-2 |
| بوب كيم | 9932777 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| الخواص | |
| الصيغة الجزيئية | [K3[Fe(C2O4)3 |
| الكتلة المولية | 437.20 غ/مول |
| المظهر | بلورات زمردية خضراء (الشكل المميَّه) |
| الكثافة | 2.13 غ/سم3 |
| نقطة الانصهار | 230 °س |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
التحضير
يحضر المركب من تفاعل كبريتات الحديد الثلاثي وأكسالات الباريوم وأكسالات البوتاسيوم:[2]
أو من تفاعل محلول من كلوريد الحديد الثلاثي مع أكسالات الباريوم:[3]
الخواص
يوجد المركب في الشروط القياسية على شكل بلورات خضراء اللون، وهي حساسة للإشعاع الكهرومغناطيسي وللضوء، حيث يؤدي امتصاص فوتون إلى تفكك الأكسالات إلى غاز ثنائي أكسيد الكربون CO2، واختزال الحديد الثلاثي إلى حديد ثنائي.[4]
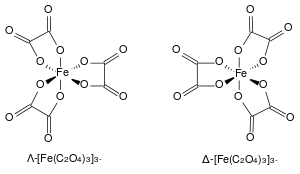
درست بنية فري أكسالات البوتاسيوم بشكل مفصل؛[5] حيث أظهرت الدراسات وجود الحديد بهيئة لف مغزلي مرتفع؛ إذ أن اللف المغزلي المنخفض للحديد سيعطي للمعقد شكلاً مشوهاً وفق تأثير يان-تيلر. لكن معقد فرّي أكسالات البوتاسيوم له بنية مختلفة، إذ له بنية متحلقة ذات خواص يدوية محورية، بالتالي يوجد متصاوغان يميز بينهما بالحرفين الإغريقيين لامدا ودلتا.[6]
الاستخدامات
يستخدم المركب لأغراض تعليمية من أجل شرح تفاعلات الكيمياء الضوئية ولقياس شدة الإشعاع.[7][8]
هوامش
- ملاحظة 1 يعرف المركب أيضاً باسم ثلاثي أكسالات فرّات البوتاسيوم
مراجع
- معرف بوب كيم: https://pubchem.ncbi.nlm.nih.gov/compound/9932777 — تاريخ الاطلاع: 14 أكتوبر 2016 — العنوان : UNII-BV5XLR9R4O — الرخصة: محتوى حر
- Bailar, John C.; Jones, Eldon M. (1939). "Trioxalato Salts (Trioxalatoaluminiate, -ferriate, -chromiate, and -cobaltiate)". Inorganic Syntheses. 1: 35–38. doi:10.1002/9780470132326.ch13. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Benjamin J. Abram, Dr. Richard Nafshun: Introduction To The Lab Manual. In: Apparel Quality Lab Manual. Fairchild Publications, ISBN 978-1-5013-0327-2
- A new sensitive chemical actinometer – II. Potassium ferrioxalate as a standard chemical actinometer. In: Proceedings of the Royal Society of London. Series A. Mathematical and Physical Sciences. Band 235, Nr. 1203, 12. Juni 1956, ISSN 2053-9169, S. 518–536, doi:10.1098/rspa.1956.0102
- Junk, Peter C. (2005). "Supramolecular interactions in the X-ray crystal structure of potassium tris(oxalato)ferrate(III) trihydrate". J. Coord. Chem. 58 (4): 355–361. doi:10.1080/00958970512331334250. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (الطبعة الثانية). Butterworth-Heinemann. ISBN 0-08-037941-9. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Hatchard, C. G.; Parker, C. A. (1956). "A new sensitive chemical actinometer. II. Potassium ferrioxalate as a standard chemical actinometer". Proceedings of the Royal Society of London. 235: 518–36. doi:10.1098/rspa.1956.0102. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: يستخدم وسيط المؤلفون (link) - Pozdnyakov, Ivan P.; Kel, Oksana V.; Plyusnin, Victor F.; Grivin, Vyacheslav P.; Bazhin, Nikolai M. (2008). "New Insight into Photochemistry of Ferrioxalate". J. Phys. Chem. A. 112 (36): 8316–8322. doi:10.1021/jp8040583. الوسيط
|CitationClass=تم تجاهله (مساعدة)
- بوابة الكيمياء