رباعي نتريد رباعي الكبريت
رباعي نتريد رباعي الكبريت هو مركب لاعضوي من الكبريت والنتروجين صيغته S4N4، ويوجد على شكل صلب بلوري ذي لون أصفر برتقالي. يعد هذا المركب واحداً من مركبات نتريدات الكبريت المتعددة.[2]
| رباعي نتريد رباعي الكبريت | |
|---|---|
 رباعي نتريد رباعي الكبريت | |
 رباعي نتريد رباعي الكبريت |
 رباعي نتريد رباعي الكبريت |
| المعرفات | |
| CAS | 28950-34-7 |
| بوب كيم | 141455 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| الخواص | |
| الصيغة الجزيئية | S4N4 |
| الكتلة المولية | 184.29 غ/مول |
| المظهر | صلب برتقالي |
| الكثافة | 2.22 غ/سم3 |
| نقطة الانصهار | 178 °س |
| نقطة الغليان | 185 °س |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
التحضير
يمكن أن يحضر المركب من تفاعل ثنائي كلوريد ثنائي الكبريت مع الأمونيا، كما حضر أول مرة سنة 1835؛[3] والتي جرى تطورها وتحسينها مع مرور الوقت.[4]
الخواص
يوجد المركب في الشروط القياسية على شكل صلب بلوري ذي لون أصفر برتقالي، وهو مستقر وثابت تجاه الهواء. ولكنه غير مستقر عند التسخين إذ يتفكك وفق المعادلة التالية:[5]
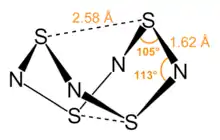
يتميز هذا المركب ببنيته المتميزة التي تشبه شكل القفص.[6]
الاستخدامات
يستخدم رباعي نتريد رباعي الكبريت مركباً طليعياً (سلف) للمركبات الحاوية على على رابطة S-N.[7]
يعطي تسخين هذا المركب بوليمراً لاعضوياً من متعدد الثيازيل SN)x)، والذي له خواص متميزة.[8][9][10]
طالع أيضاً
مراجع
- معرف بوب كيم: https://pubchem.ncbi.nlm.nih.gov/compound/141455 — تاريخ الاطلاع: 14 أكتوبر 2016 — العنوان : Tetrasulfur tetranitride — الرخصة: محتوى حر
- Chivers, T. (2004). A Guide To Chalcogen-Nitrogen Chemistry. Singapore: World Scientific Publishing. ISBN 981-256-095-5. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Jolly, W. L.; Lipp, S. A. (1971). "Reaction of Tetrasulfur Tetranitride with Sulfuric Acid". Inorganic Chemistry. 10 (1): 33–38. doi:10.1021/ic50095a008. مؤرشف من الأصل في 06 مايو 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Villena-Blanco, M.; Jolly, W. L.; et al. (1967). S. Y. Tyree Jr (المحرر). "Tetrasulfur Tetranitride, S4N4". Inorganic Syntheses. 9: 98–102. doi:10.1002/9780470132401.ch26. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Greenwood, N. N.; Earnshaw, A. (1997). Chemical Elements (الطبعة 2nd). Boston, MA: Butterworth-Heinemann. صفحات 721–725. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Sharma, B. D.; Donohue, J. (1963). "The Crystal and Molecular Structure of Sulfur Nitride, S4N4". Acta Crystallographica. 16 (9): 891–897. doi:10.1107/S0365110X63002401. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Bojes, J.; Chivers, T.; Oakley, R. D.; et al. (1989). Allcock, H. R. (المحرر). "Binary Cyclic Nitrogen-Sulfur Anions". Inorganic Syntheses. 25: 30–35. doi:10.1002/9780470132562.ch7. ISBN 9780470132562. الوسيط
|CitationClass=تم تجاهله (مساعدة) - N. N. Greenwood, A. Earnshaw: Chemical Elements. 2. Auflage. Butterworth-Heinemann, Boston, MA 1997, S. 721–725.
- T. Chivers: Guide To Chalcogen-Nitrogen Chemistry. World Scientific Publishing Company, Singapore 2004, ISBN 981-256-095-5.
- Greene, R. L.; Street, G. B.; Suter, L. J. (1975). "Superconductivity in Polysulfur Nitride (SN)x". Physical Review Letters. 34 (10): 577–579. Bibcode:1975PhRvL..34..577G. doi:10.1103/PhysRevLett.34.577. الوسيط
|CitationClass=تم تجاهله (مساعدة)
- بوابة الكيمياء
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.
