خماسي أكسيد ثنائي النتروجين
خماسي أكسيد ثنائي النتروجين (أو خماسي أكسيد النتروجين) هو مركب كيميائي من النتروجين والأكسجين له الصيغة N2O5 ويكون على شكل مادة صلبة بيضاء اللون.
| خماسي أكسيد ثنائي النتروجين | |
|---|---|
 خماسي أكسيد ثنائي النتروجين | |
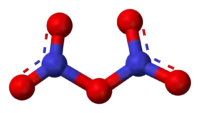 خماسي أكسيد ثنائي النتروجين | |
| الاسم النظامي (IUPAC) | |
Dinitrogen pentaoxide | |
| المعرفات | |
| رقم CAS | 10102-03-1 |
| بوب كيم (PubChem) | 66242 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| الخواص | |
| الصيغة الجزيئية | N2O5 |
| الكتلة المولية | 108.01 غ/مول |
| المظهر | صلب |
| الكثافة | 1.64 غ/سم3 |
| نقطة الانصهار | 41 °س |
| نقطة الغليان | 47 °س يتسامى |
| الذوبانية في الماء | يتفاعل |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
إن خماسي أكسيد ثنائي النتروجين هو مركب غير مستقر كيميائياً، ويصنف ضمن أكاسيد النتروجين العليا، وهو بلاماء حمض النتريك.
التحضير
حضر N2O5 لأول مرة سنة 1840 من قبل الكيميائي ديفيل Deville، وذلك من معالجة نترات الفضة بغاز الكلور.[3][4] كما يحضر مخبرياً بشكل أفضل من تفاعل نزع ماء من حمض النتريك باستخدام مركب شره للماء ونازع له مثل خماسي أكسيد الفوسفور:[5][6]
يمكن التحضير بأسلوب آخر وذلك من تفاعل أملاح النترات مع فلوريد النتريل (NO2F) أو من تفاعل حمض النتريك المركز مع فلوريد الهيدروجين. كما يمكن أن يحضر المركب من أكسدة ثنائي أكسيد النتروجين، والذي يكون في الطور الغازي على شكل ديمر من N2O4، وذلك بغاز الأوزون:[5]
منذ سنة 1983 أصبح من الممكن إجراء التحضير على مستوى صناعي من التحليل الكهربائي لحمض النتريك، وذلك بغياب رباعي أكسيد ثنائي النتروجين.[7]
الخصائص
يكون خماسي أكسيد ثنائي النتروجين في الشروط العادية على شكل بلورات بيضاء اللون تعطي عند تفاعلها مع الماء حمض النتريك:
ينحل المركب في الكلوروفورم ورباعي كلورو الميثان وثلاثي كلورو فلورو الميثان والسلفولان، وبكن يجب أن تكون تلك المذيبات عند الدرجة 0 °س، وإلا تفكك المركب. إن N2O5 غير مستقر ويتفكك ليعطي ثنائي أكسيد النتروجين والأكسجين.[8] عند التسخين يتسرع تفاعل التفكك بشكل عنيف:
اقرأ أيضاً
المراجع
- معرف بوب كيم: https://pubchem.ncbi.nlm.nih.gov/compound/66242 — تاريخ الاطلاع: 20 نوفمبر 2016 — العنوان : Nitrogen pentoxide — الرخصة: محتوى حر
- معرف بوب كيم: https://pubchem.ncbi.nlm.nih.gov/compound/66242
- M.H. Deville (1849). "Note sur la production de l'acide nitrique anhydre". Compt. Rend. 28: 257–260. مؤرشف من الأصل في 7 مارس 2016. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Jai Prakash Agrawal (19 April 2010). High Energy Materials: Propellants, Explosives and Pyrotechnics. Wiley-VCH. صفحات 117–. ISBN 978-3-527-32610-5. مؤرشف من الأصل في 08 مارس 2020. اطلع عليه بتاريخ 20 سبتمبر 2011. الوسيط
|CitationClass=تم تجاهله (مساعدة) - G. Brauer (Hrsg.): Handbook of Preparative Inorganic Chemistry, 2nd ed., vol. 1, Academic Press 1963, S. 489–490.
- Holleman, A. F.; Wiberg, E. (2001), Inorganic Chemistry, San Diego: Academic Press, ISBN 0-12-352651-5 الوسيط
|CitationClass=تم تجاهله (مساعدة); الوسيط|separator=تم تجاهله (مساعدة)CS1 maint: ref=harv (link) - Klapötke, Thomas M. (2009), Chemie der hochenergetischen Materialien, Walter de Gruyter, صفحة 142, ISBN 311021487-3 الوسيط
|CitationClass=تم تجاهله (مساعدة); الوسيط|separator=تم تجاهله (مساعدة)CS1 maint: ref=harv (link) - Nitrogen(V) Oxide. 3. 1950. صفحات 78–81. الوسيط
|CitationClass=تم تجاهله (مساعدة)
- بوابة الكيمياء
 صور وملفات صوتية من كومنز
صور وملفات صوتية من كومنز
