خثار وريدي
الخثار الوريدي هو جلطة دموية (خثرة) تتشكل ضمن الوريد. يُستخدم مصطلح الخثار للتعبير عن حدوث الخثرة داخل وعاء دموي. يُعد الخثار الوريدي العميق (دي في تي) أحد الأنواع الشائعة للخثار الوريدي، وهو تشكل خثرة في الأوردة العميقة في الساق. إذا انفصلت الخثرة (تحولت إلى صمة) وسارت باتجاه الرئتين، فقد تسبب انصمامًا رئويًا (بّي إي)، أي جلطة دموية في الرئتين. يُسمى هذا المزيج الانصمام الخثاري الوريدي.
| الخثار الوريدي | |
|---|---|
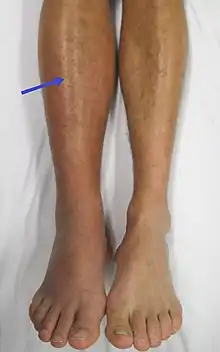 جلطة في الساق اليمنى. لاحظ الانتفاخ والاحمرار في الساق. جلطة في الساق اليمنى. لاحظ الانتفاخ والاحمرار في الساق. | |
| معلومات عامة | |
| الاختصاص | طب القلب |
| من أنواع | خثار |
يشمل العلاج الأولي للانصمام الخثاري الوريدي نموذجيًا إما الهيبارين منخفض الوزن الجزيئي (إل إم دبليو إتش) أو الهيبارين غير المجزأ، أو مضادات التخثر الفموية المباشرة (دي أو إيه سي) التي أصبحت تُستخدم على نحو متزايد. يمكن تغيير العلاج لدى أولئك الذين عولجوا أوليًا بالهيبارين إلى مضادات التخثر الأخرى (الوارفارين ومضادات التخثر الفموية المباشرة)، لكن يتلقى الأشخاص المصابون بالسرطان والنساء الحوامل عمومًا علاجًا مستمرًا بالهيبارين. يتطلب علاج الخثار الوريدي السطحي استخدام مضادات التخثر في حالات محددة، وقد يُعالج بمسكنات الألم المضادة للالتهاب فقط.
التصنيف
الأشكال الشائعة
يؤدي الخثار الوريدي السطحي إلى حس عدم ارتياح، ولكن عمومًا لا يتسبب بأي عواقب خطيرة، وكذلك الأمر في ما يتعلق بالخثار الوريدي العميق الذي يتشكل في الأوردة العميقة في الساق أو في الأوردة الحوضية. مع ذلك، قد يتقدم المرض إلى الأوردة العميقة عبر الأوردة الثاقبة، أو قد تكون مسؤولة عن الصمة الرئوية بصورة رئيسية إذا كان رأس الخثرة ضعيف الارتباط بجدار الوريد ويقع قرب الوصل الصافني الفخذي.
حين تنفصل الخثرة الدموية وتجول في الدم، تُسمى هذه الحالة الانصمام الخثري الوريدي (في تي إي). يشير الاختصار «دي في تي/ بّي إي» إلى انصمام خثري وريدي انتقلت فيه خثرة وريد عميق إلى الرئتين (الانصمام الرئوي).[1]
بما أن الأوردة تعيد الدم إلى القلب، فإذا انفصلت قطعة من الخثرة المتشكلة داخل الوريد، فإنها قد تنتقل إلى القسم الأيمن من القلب، ثم إلى الرئتين. تُسمى قطعة الخثرة التي انتقلت بهذا الطريقة السدادة (الصمة): تُسمى عملية تشكل الخثرة التي تصبح صمية الانصمام الخثري. تُسمى الصمة التي تستقر في الرئتين الصمة الرئوية (الانصمام الرئوي). الصمة الرئوية هي حالة خطيرة جدًا قد تكون قاتلةً وهذا يعتمد على أبعاد الصمة. يشير الانصمام الخثري إلى كل من الخثار الوريدي العميق والانصمام الرئوي.
الأشكال النادرة
في حين يعد الخثار الوريدي في الساق أكثر الأشكال شيوعًا، فقد يحدث هذا الخثار في أوردة أخرى. قد تملك الحالات الآتية عوامل خطورة خاصة محددة:[2]
- خثار الجيب الوريدي المخي وخثار الجيب الكهفي وخثار الوريد الوداجي: خثار في أوردة الدماغ والرأس.
- انسداد الوريد الشبكي المركزي وانسداد الوريد الشبكي الفرعي.
- مرض باجيت شروتر: خثار في أوردة الذراع (الأوردة الإبطية والأوردة تحت الترقوة).
- خثار الوريد المساريقي، الذي قد يسبب الإقفار المساريقي (الجلطة المعوية، أي نقص تروية الأمعاء).
- متلازمة بود كياري (خثار الأوردة الكبدية) وخثار الوريد البابي.
- خثار الوريد الطحالي.
- خثار الوريد الكلوي (خثار أوردة الكليتين).
الصمة العجائبية
قد تحدث الصمة الجهازية ذات المنشأ الوريدي لدى المرضى المصابين بعيوب الحاجز الأذيني أو البطيني، أو الذين يعانون اتصالًا شريانيًا وريديًا في الرئة تتمكن الخثرة من خلاله من العبور إلى الجهاز الشرياني. يُطلق على هذا الحدث مصطلح الصمة العجائبية. حين تطال الصمة الأوعية الدموية للدماغ، فقد تؤدي إلى حدوث سكتة.[3]
الأسباب
تنتج الخثرات الوريدية بصورة رئيسية عن اجتماع الركود الوريدي وفرط الخثورية؛ ولكن تنتج بصورة أقل عن الأذية البطانية والفعالية الالتهابية التالية للأذية. تشكل العوامل الثلاثة من ركود وفرط خثورية وتبدلات في جدار الوعاء الدموي ثلاثي فيرشو، وتعد التغيرات في جدار الوعاء أقلها فهمًا. تزيد عوامل خطورة متنوعة احتمالية تطور خثار لدى الفرد.
المكتسبة
- العمر المتقدم.
- الجراحة الكبرى، والجراحة العظمية، والجراحة العصبية.
- السرطانات، وعلى وجه الخصوص سرطان البنكرياس، ما عدا سرطانات الشفة والتجويف الفموي والبلعوم.
- التثبيت، كما هو الحال في الجبائر العظمية، ووضعية الجلوس، والسفر وبالأخص جوًا.
- الحمل وفترة النفاس.
- متلازمة أضداد الفوسفوليبيد (مثل أضداد التخثر الذأبية).
- الرض وأذيات الساق الصغرى.
- انصمام خثري وريدي سابق.
- مانعات الحمل الفموية.
- المعالجة الهرمونية المعيضة، وخاصة الفموية.
- القثاطر الوريدية المركزية.
- الأمراض الالتهابية وبعض الأمراض المناعية الذاتية.
- المتلازمة الكلوية (المتلازمة النفروزية).
- السمنة.
- العدوى (الخمج).
- فيروس العوز المناعي البشري.
- الأمراض التكاثرية النقوية بما في ذلك كثرة الصفيحات الأساسية وكثرة الحمر الحقيقية.
- العلاج الكيميائي.
- قصور القلب.
الوراثية
- عوز مضاد الثرومبين الثالث III.
- عوز البروتين سي C.
- عوز البروتين إس S (النمط الأول).
- العامل الخامس لايدن.
- البروثرومبين G20210A.
- خلل فرط فيبرينوجين الدم.
- جميع الزمر الدموية عدا الزمرة O.
المختلطة
- نقص بروتين إس الحر.
- مقاومة البروتين سي الفعال.
- المستويات العالية من العامل الثامن.
- فرط هوموسيستين الدم.
- مستويات الفيبرينوجين العالية.
- مستويات العامل التاسع العالية.
- مستويات العامل الحادي عشر العالية.[4]
يبلغ الخطر المطلق الكلي للخثار الوريدي لكل مئة ألف امرأة يستخدمن مانعات الحمل المركبة نحو 60، بالمقارنة مع 30 عند اللاتي لا يستخدمن هذه المانعات. يتنوع خطر حدوث الانصمام الخثاري حسب الأنواع المختلفة من حبوب منع الحمل؛ بالمقارنة مع مانعات الحمل الفموية المركبة الحاوية على النورجستريل (إل إن جي)، وبنفس الجرعة من الإستروجين ومدة الاستخدام، تصل نسبة معدل الخثار الوريدي العميق عند استخدام مانعات الحمل الفموية المركبة الحاوية على النوريثيستيرون إلى 0.98، والنورجيستيمات إلى 1.19، والديسوجيستريل (دي إس جي) إلى 1.82، والجيستودين إلى 1.86، والدروسبيرينون (دي آر إس بّي) إلى 1.64، والسيبروتيرون أسيتات إلى 1.88. يحدث الانصمام الخثاري الوريدي لدى 100-200 لكل 100,000 امرأة حامل كل عام.
في ما يخص السوابق العائلية، يؤدي العمر إلى تعديل ذي تأثير جوهري. بالنسبة للأفراد الذين حدث الخثار لدى اثنين أو أكثر من أشقائهم، تظهر أعلى معدلات للإصابة بين أولئك الذين تخطوا عمر السبعين (390 لكل 100,000 من الأفراد الذكور، و370 لكل 100,000 من الأفراد الإناث)، في حين ظهرت أعلى نسبة إصابة بالمقارنة مع أولئك الذين لم يحدث الخثار لدى أشقائهم عند أعمار أصغر بكثير (بنسبة 4.3 لدى الأفراد الذكور بعمر بين 20 و29 عامًا، و5.5 لدى الأفراد الإناث بعمر بين 10 و19 عامًا).
الفيزيولوجيا المرضية
على العكس من فهم كيفية حدوث الخثرات الشريانية، كما في النوبات القلبية، فإن تشكل الخثرات الوريدية غير مفهوم بصورة جيدة. في الخثار الشرياني، يتطلب تشكل الخثرة حدوث أذية في جدار الوعاء الدموي، مطلقةً شلال التخثر (تجلط الدم)، لكن غالبية الخثرات الوريدية تتشكل دون حدوث أي أذية للظهارة.[5]
تشكل كريات الدم الحمراء والفيبرين المكونات الأساسية للخثرات الوريدية، ويبدو أن الخثرات ترتبط بظهارة جدار الوعاء الدموي، الذي يكون عادةً سطحًا غير مخثِّر، بواسطة الفيبرين. ترتبط الصفيحات بالفيبرين في مجرى الدم في الخثرات الوريدية، في حين تتوضع الصفيحات في المركز في الخثرات الشريانية. تساهم الصفيحات ككل بشكل أقل في بنية الخثرات الوريدية بالمقارنة مع تلك الشريانية. يُعتقَد أن هذه العملية تبدأ بواسطة نواتج الثرومبين المتأثر بالعامل النسيجي، والذي يؤدي إلى ترسب الفيبرين.
تُعتبر صمامات (دسامات) الأوردة موقعًا معروفًا لبدء الخثار الوريدي. نظرًا إلى نمط تدفق الدم، تكون قاعدة جيب الصمام محرومة من الأوكسجين (ناقصة التأكسج). يفاقم الركود نقص التأكسج، وترتبط هذه الحالة بتفعيل كريات الدم البيضاء والبطانة. على وجه التحديد، ينشّط نقص الأكسجة سبيلي العامل المحفَّز بنقص التأكسج الأول (إتش آي إف 1) وبروتين استجابة النمو الباكرة، فيساهمان بدورهما في تنشيط الخلايا الوحيدة والبطانة. يؤدي نقص التأكسج أيضًا إلى إنتاج أنواع الأكسجين التفاعلية (آر أو إس) التي تستطيع أن تنشط العامل المحفز بنقص التأكسج الأول، وبروتين استجابة النمو الباكرة، والعامل النووي المعزز لسلسلة كابا الخفيفة في الخلايا البائية النشطة، والذي ينظم انتساخ العامل الأول المحفز بنقص التأكسج.
يؤدي سبيلا العامل المحفز بنقص التأكسج الأول وبروتين استجابة النمو الباكرة إلى ارتباط الخلايا الوحيدة ببروتينات البطانة، مثل بروتين بّي-سيليكتين، ما يدفع الخلايا الوحيدة لإطلاق حويصلات صغيرة مليئة بالعامل النسيجي، والتي يُفترَض أن تطلق عملية ترسب الفيبرين (عبر الثرومبين) بعد الارتباط بالسطح البطاني.
المراجع
- National Clinical Guideline Centre – Acute and Chronic Conditions (UK) (2010). "Venous Thromboembolism: Reducing the Risk of Venous Thromboembolism (Deep Vein Thrombosis and Pulmonary Embolism) in Patients Admitted to Hospital". PMID 23346611. الوسيط
|CitationClass=تم تجاهله (مساعدة); Cite journal requires|journal=(مساعدة) - Shatzel, Joseph J.; O'Donnell, Matthew; Olson, Sven R.; Kearney, Matthew R.; Daughety, Molly M.; Hum, Justine; Nguyen, Khanh P.; DeLoughery, Thomas G. (January 2019). "Venous thrombosis in unusual sites: A practical review for the hematologist". European Journal of Haematology. 102 (1): 53–62. doi:10.1111/ejh.13177. ISSN 0902-4441. PMID 30267448. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Windecker, Stephan; Stortecky, Stefan; Meier, Bernhard (July 2014). "Paradoxical Embolism". Journal of the American College of Cardiology. 64 (4): 403–415. doi:10.1016/j.jacc.2014.04.063. PMID 25060377. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Eikelboom, J. W.; Weitz, J. I. (2011). "Importance of family history as a risk factor for venous thromboembolism". Circulation. 124 (9): 996–7. doi:10.1161/CIRCULATIONAHA.111.048868. PMID 21875920. الوسيط
|CitationClass=تم تجاهله (مساعدة) - López JA, Chen J (2009). "Pathophysiology of venous thrombosis". Thromb Res. 123 (Suppl 4): S30–4. doi:10.1016/S0049-3848(09)70140-9. PMID 19303501. الوسيط
|CitationClass=تم تجاهله (مساعدة)
