حمض الهيبوفوسفوروز
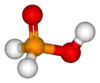
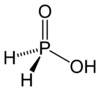
حمض الهيبوفوسفوروز [3] (أو حسب التسمية النظامية حمض الفوسفينيك) هو حمض أكسجيني للفوسفور صيغته H3PO2، ويوجد على شكل صلب بلوري عديم اللون سهل التسيّل.
| حمض الهيبوفوسفوروز[1] | |
|---|---|
 حمض الهيبوفوسفوروز |
 حمض الهيبوفوسفوروز |
| الاسم النظامي (IUPAC) | |
Phosphinic acid | |
| المعرفات | |
| CAS | 6303-21-5 |
| بوب كيم | 4124402 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| الخواص | |
| الصيغة الجزيئية | H3PO2 |
| الكتلة المولية | 66.00 غ/مول |
| المظهر | بلورات عديمة اللون سهلة التسيل |
| الكثافة | 1.49 غ/سم3 |
| نقطة الانصهار | 26.5 °س |
| نقطة الغليان | 108 °س (يتفكك) |
| الذوبانية في الماء | سهل الانحلال |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
تسمى أملاح هذا الحمض «فوسفينات»، كما يطلق عليها أيضاَ اسم «هيبوفوسفيتات».[4]
التحضير
كان الكيميائي الفرنسي بيير لوي دولون أوّل من حضّر هذا الحمض، وذلك سنة 1816.[5]
يحضَّر هذا المركب من تفاعل تحلل مائي (حلمهة) للفوسفور الأبيض في وسط قلوي:
أو من يستحصل عليه من أملاح الهيبوفوسفيت بأثر من حمض الكبريتيك:[6]
الخواص
يوجد هذا المركب في الشروط القياسية على شكل بلورات صفائحية عديمة اللون سهلة التسيّل، وسهلة الانحلال في الماء، كما تنحل في الديوكسان والكحولات. يكون للفوسفور في هذا الحمض حالة أكسدة مقدارها +1، لذلك فهو مختزل جيد؛ كما أن هذا الحمض أحادي البروتون، أي أنه قادر على منح بروتون واحد فقط، وهو الهيدروجني المرتبط بذرة الأكسجين، لذلك تكتب صيغته أحياناً على الشكل HOP(O)H2.
يؤدي التسخين إلى درجات حرارة بين 130–140 °س إلى حدوث تفاعل عدم تناسب، بحيث ينتج غاز الفوسفين وحمض الفوسفوروز:[6]
الاستخدامات
يستخدم حمض الهيبوفوسفوروز بشكل رئيسي في المختبرات الكيميائية ضمن المختزلات، وذلك على أملاح الديازونيوم على سبيل المثال؛[7][8][9] أو لاختزال أكسيد الكروم الثلاثي إلى الثنائي:
طالع أيضاً
مراجع
- Petrucci, Ralph H. (2007). General Chemistry (الطبعة 9th). صفحة 946. الوسيط
|CitationClass=تم تجاهله (مساعدة) - معرف بوب كيم: https://pubchem.ncbi.nlm.nih.gov/compound/3085127 — تاريخ الاطلاع: 21 سبتمبر 2016 — العنوان : Hypophosphorous acid-d3 solution — الرخصة: محتوى حر
- "معجم المصطلحات العلمية والتقنية الجديد". مكتبة لبنان ناشرون. مؤرشف من الأصل في 5 يناير 2020. اطلع عليه بتاريخ 01/2020. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ الوصول=(مساعدة) - Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (الطبعة الثانية). Butterworth-Heinemann. ISBN 0-08-037941-9. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Graham, Thomas, Elements of Inorganic Chemistry, 2nd ed. (Philadelphia, Pennsylvania: Blanchard and Lea, 1858), p. 316. نسخة محفوظة 5 يناير 2020 على موقع واي باك مشين.
- Georg Brauer (Hrsg.): Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 539.
- William H. Brown; Brent L. Iverson; Eric Anslyn; Christopher S. Foote (2013). Organic Chemistry. Cengage Learning. صفحة 1003. ISBN 9781133952848. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "2,4,6-Tribromobenzoic acid". Org. Synth.36; Coll. Vol. 4.
- Kornblum, N.(1941)."3,3′-Dimethoxybiphenyl and 3,3′-Dimethylbiphenyl". Org. Synth.21. DOI:10.15227/orgsyn.021.0030.
- بوابة الكيمياء
 صور وملفات صوتية من كومنز
صور وملفات صوتية من كومنز