ثنائي أكسيد ثنائي الكبريت
ثنائي أكسيد ثنائي الكبريت هو أكسيد من أكاسيد الكبريت،[1] صيغته الكيميائية S2O2، ويوجد على شكل غاز عديم اللون في الشروط القياسية.
| ثنائي أكسيد ثنائي الكبريت | |
|---|---|
 ثنائي أكسيد ثنائي الكبريت | |
 ثنائي أكسيد ثنائي الكبريت | |
| المعرفات | |
| CAS | 126885-21-0 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| الخواص | |
| الصيغة الجزيئية | S2O2 |
| الكتلة المولية | 96.13 غ/مول |
| المظهر | غاز |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
يمكن أن يعد هذا الأكسيد ثنائي وحدات من أحادي أكسيد الكبريت، وهو غير مستقر، إذ سرعان ما يتفكك.[2] ينتمي المركب كيميائياً إلى تحت أكاسيد الكبريت.
التحضير
يتحول أحادي أكسيد الكبريت إلى ثنائي أكسيد ثنائي الكبريت بشكل تلقائي وعكوس؛[3] بالتالي يستحصل عليه من أساليب تحضير أحادي أكسيد الكبريت.
كما يمكن أن يتم التحضير من ثنائي أكسيد الكبريت بإجراء تفريغ كهربائي فيه؛[4] أو بالتعريض لأشعة الميكرويف في وسط ممدد من الهليوم؛[5][6] أو عن طريق تفاعل ذرات الأكسجين مع بخار كبريتيد الكربونيل أو ثنائي كبريتيد الكربون.[7]
يستحصل أيضاً على هذا الأكسيد من تفاعل الكبريت مع ثنائي أكسيد الكبريت عند درجات حرارة مرتفعة، حيث ينتج أحادي أكسيد الكبريت، الذي تحدث له تفاعل تضاعف للحصول على ثنائي أكسيد ثنائي الكبريت.[8]
الخواص
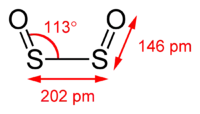
لمركب ثنائي أكسيد ثنائي الكبريت بنية مستوية من النمط المقرون (cis). يبلغ طول الرابطة S-O مقدار 145.8 بيكومتر، وهي أقصر مما هي عليه في أحادي أكسيد الكبريت؛ أما طول الرابطة S-S فيبلغ 202.45 بيكومتر؛ في حين أن زاوية الرابطة OSS تبلغ 112.7°؛ وللمركب عزم ثنائي قطب مقداره 3.17 ديباي؛[3] وهو مثال على الجزيئات اللامتناظرة.[9][4]
تبلغ طاقة تأين المركب مقدار 9.93±0.02 إلكترون فولت؛[7] ويمتص المركب عند مجال من الطيف الكهرومغناطيسي يقع بين 320–400 نانومتر، كما لوحظ في الغلاف الجوي للزهرة،[10] حيث يظن أن له تأثيراً عليه.[11] كما درست حالات بشكل فيه هذا المركب أنيوناً سالباً −S2O2 في الطور الغازي.[12]
على الرغم من وجود ثنائي أكسيد ثنائي الكبريت في حالة توازن كيميائي مع أحادي أكسيد الكبريت، إلا أنه يستطيع التفاعل معه ضمن شروط خاصة للحصول على ثنائي أكسيد الكبريت وأحادي أكسيد ثنائي الكبريت.[5][13]
الاستخدامات
يستخدم مركب ثنائي أكسيد ثنائي الكبريت في الأبحاث الكيميائية على شكل ربيطة مع الفلزات الانتقالية.[14][15][16][16][17]
مراجع
- Arnold F. Holleman; Egon Wiber; Nils Wiberg, المحررون (2001). "Oxides of sulfur". Inorganic Chemistry. Academic Press. صفحة 530. ISBN 9780123526519. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Mitchell, Stephen C. (3 September 2004). Biological Interactions Of Sulfur Compounds. CRC Press. صفحة 7. ISBN 978-0203362525. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Spectroscopic studies of the SO2 discharge system. II. Microwave spectrum of the SO dimer Lovas F. J., Tiemann E., Johnson D.R. The Journal of Chemical Physics (1974), 60, 12, 5005-5010 doi:10.1063/1.1681015
- Thorwirth, Sven; P. Theulé; C. A. Gottlieb; H. S. P. Müller; M. C. McCarthy; P. Thaddeus (23 February 2006). "Rotational spectroscopy of S2O: vibrational satellites, 33 S isotopomers, and the submillimeter-wave spectrum" (PDF). Journal of Molecular Structure. 795 (1–3): 219–229. Bibcode:2006JMoSt.795..219T. doi:10.1016/j.molstruc.2006.02.055. مؤرشف من الأصل (PDF) في 09 أغسطس 2017. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Field, T A; A E Slattery; D J Adams; D D Morrison (2005). "Experimental observation of dissociative electron attachment to S2O and S2O2 with a new spectrometer for unstable molecules" (PDF). Journal of Physics B: Atomic, Molecular and Optical Physics. 38 (3): 255–264. Bibcode:2005JPhB...38..255F. doi:10.1088/0953-4075/38/3/009. ISSN 0953-4075. مؤرشف من الأصل (PDF) في 24 سبتمبر 2015. اطلع عليه بتاريخ 13 مايو 2013. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Pujapanda, Balaram Sahoo, Nimain C. Nayak, Asutosh Samantaray, Prafulla K.; Balaram, Sahoo; Charan, nayak Nimai; samantaray Asutosh; pujapanda Prafulla Kumar (2012). Inorganic Chemistry. PHI Learning Pvt. Ltd. صفحة 461. ISBN 9788120343085. مؤرشف من الأصل في 22 أبريل 2020. اطلع عليه بتاريخ 16 مايو 2013. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Cheng, Bing-Ming; Wen-Ching Hung (1999). "Photoionization efficiency spectrum and ionization energy of S[sub 2]O[sub 2]". The Journal of Chemical Physics. 110 (1): 188. Bibcode:1999JChPh.110..188C. doi:10.1063/1.478094. ISSN 0021-9606. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Murakami, Yoshinori; Shouichi Onishi; Takaomi Kobayashi; Nobuyuki Fujii; Nobuyasu Isshiki; Kentaro Tsuchiya; Atsumu Tezaki; Hiroyuki Matsui (2003). "High Temperature Reaction of S + SO2→ SO + SO: Implication of S2O2Intermediate Complex Formation". The Journal of Physical Chemistry A. 107 (50): 10996–11000. Bibcode:2003JPCA..10710996M. doi:10.1021/jp030471i. ISSN 1089-5639. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Demaison, Jean; Vogt, Jürgen (2011). "836 O2S2 Disulfur dioxide" (PDF). Asymmetric Top Molecules, Part 3. 29D3. Springer. صفحة 492. doi:10.1007/978-3-642-14145-4_258. ISBN 978-3-642-14145-4. الوسيط
|CitationClass=تم تجاهله (مساعدة) - BN Frandsen; PO Wennberg; HG Kjaergaard (2016). "Identification of OSSO as a near-UV absorber in the Venusian atmosphere" (PDF). Geophys. Res. Lett. 43 (21): 11, 146. Bibcode:2016GeoRL..4311146F. doi:10.1002/2016GL070916. مؤرشف من الأصل (PDF) في 19 يوليو 2018. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Rare molecule on Venus may help explain planet's weather - Technology & Science - CBC News". Cbc.ca. مؤرشف من الأصل في 18 أكتوبر 2018. اطلع عليه بتاريخ 11 نوفمبر 2016. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Clements, Todd G.; Hans-Jürgen Deyerl; Robert E. Continetti (2002). "Dissociative Photodetachment Dynamics of S2O2-" (PDF). The Journal of Physical Chemistry A. 106 (2): 279–284. Bibcode:2002JPCA..106..279C. doi:10.1021/jp013329v. ISSN 1089-5639. مؤرشف من الأصل (PDF) في 22 أبريل 2020. اطلع عليه بتاريخ 13 مايو 2013. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Herron, J. T.; R. E. Huie (1980). "Rate constants at 298 K for the reactions sulfur monoxide + sulfur monoxide + M -> dimeric sulfur monoxi de + M and sulfur monoxide + dimeric sulfur monoxide -> sulfur dioxide + sulfur oxide (S2O)". Chemical Physics Letters. 76 (2): 322–324. Bibcode:1980CPL....76..322H. doi:10.1016/0009-2614(80)87032-1. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Halcrow, Malcolm A.; John C. Huffman; George Christou (1994). "Synthesis, Characterization, and Molecular Structure of the New S2O Complex Mo(S2O)(S2CNEt2)3.cntdot.1/2Et2O" (PDF). Inorganic Chemistry. 33 (17): 3639–3644. doi:10.1021/ic00095a005. ISSN 0020-1669. مؤرشف من الأصل (PDF) في 06 نوفمبر 2015. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Lorenz, Ingo-Peter; Jürgen Kull (1986). "Complex Stabilization of Disulfur Dioxide in the Fragmentation of ThiiraneS-Oxide on Bis(triphenylphosphane)platinum(0)". Angewandte Chemie International Edition in English. 25 (3): 261–262. doi:10.1002/anie.198602611. ISSN 0570-0833. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Schmid, Günter; Günter Ritter; Tony Debaerdemaeker (1975). "Die Komplexchemie niederer Schwefeloxide, II. Schwefelmonoxid und Dischwefeldioxid als Komplexliganden". Chemische Berichte. 108 (9): 3008–3013. doi:10.1002/cber.19751080921. ISSN 0009-2940. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Nagata, K; N. Takeda; N Tokitoh N (2003). "Unusual Oxidation of Dichalcogenido Complexes of Platinum". Chemistry Letters. 32 (2): 170–171. doi:10.1246/cl.2003.170. ISSN 0366-7022. الوسيط
|CitationClass=تم تجاهله (مساعدة)
 صور وملفات صوتية من كومنز
صور وملفات صوتية من كومنز
- بوابة الكيمياء