ثنائي أكسيد الكلور
ثاني أكسيد الكلور هو مركب كيميائي ذو الصيغة ClO2. يتبلور غاز ثاني أكسيد الكلور ذو اللون الأصفر المخضر إلى بلورات برتقالية لامعة عند درجة حرارة −59 °م. وكما هو الحال مع الأكاسيد المتعددة للكلور فإن ثاني أكسيد الكلور مؤكسد قوي ومفيد يستخدم في معالجة المياه وعملية القصر أو التبييض.[2]
| ثنائي أكسيد الكلور | |
|---|---|
 ثنائي أكسيد الكلور |
 ثنائي أكسيد الكلور |
 ثنائي أكسيد الكلور | |
| الاسم النظامي (IUPAC) | |
ثاني أكسيد الكلور | |
| المعرفات | |
| رقم CAS | 10049-04-4 |
| بوب كيم (PubChem) | 24870 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| |
| الخواص | |
| صيغة كيميائية | ClO2 |
| كتلة مولية | 67.45 غ.مول−1 |
| المظهر | غاز أصفر |
| الرائحة | لاذع |
| الكثافة | 2.757 غ دسم−3[1] |
| نقطة الانصهار | -59 °س، 214 °ك، -74 °ف |
| نقطة الغليان | 11 °س، 284 °ك، 52 °ف |
| الذوبانية في الماء | 8 غ دسم-3 (عند 20 °م) |
| حموضة (pKa) | 3.0(5) |
| كيمياء حرارية | |
| الحرارة القياسية للتكوين ΔfH |
104.60 كجول مول-1 |
| إنتروبيا مولية قياسية S |
257.22 جول كلفن-1 مول-1 |
| المخاطر | |
| صحيفة بيانات سلامة المادة | ICSC 0127 |
| فهرس المفوضية الأوروبية | 017-026-00-3 |
| ترميز المخاطر |  O O
 N N |
| توصيف المخاطر | |
| تحذيرات وقائية | |
| NFPA 704 |
0
3
4
OX |
| LD50 | 292 mg/kg (فموي، جرذ) |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
البنية والروابط

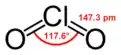
لجزيء ClO2 عدد شاذ من إلكترونات التكافؤ ولذلك هو جذر حر ذو مغناطيسية مسايرة. لقد حيرت بنيته الإلكترونية العلماء لفترة طويلة لعدم الرضى التام عن أي ترتيب ممكن من ترتيبات لويس. في سنة 1933 م اقترح (L.O. Brockway) بنية تتضمن رابطة ثلاثية الإلكترونات.[3] طور الكيميائي لينوس باولنغ لاحقًا هذه الفكرة وتوصل إلى بنيتين طنينيتين تتضمن رابطة مضاعفة في جهة واحدة ورابطة مفردة مع رابطة ثلاثية الإلكترونات في الجهة الأخرى.[4] من وجهة نظر باولينغ فإن التركيب الأخير يجب أن يمثل رابطة أضعف قليلًا من الرابطة المزدوجة.
الاستخدامات
يستخدم ثاني أكسيد الكلور في المقام الأول (95%) في قصر لب الخشب، ولكنه يستخدم أيضا في قصر الطحين وفي تطهير مياه الشرب البلدية.[5][6] استخدمت شلالات نياجارا، ومحطة معالجة المياه في نيويورك غاز ثاني أكسيد الكلور في معالجة مياه الشرب في سنة 1944 من أجل تفكيك الفينول.:4-17[6] أدخل غاز ثاني أكسيد الكلور كمطهر لمياه الشرب على نحو واسع في سنة 1956، عندما انتقلت بروكسل في بلجيكا من غاز الكلور إلى غاز ثاني أكسيد الكلور.[6] ويستخدم على نحو شائع في معالجة المياه لأكسدته قبل عملية كلورة المياع من أجل تفكيك الشوائب الموجودة في المياه والتي تولد ثلاثي هالو الميثان عند التعرض إلى الكلور الحر.[7][8][9] يشتبه بأن ثلاثي هالو الميثان بأنه مركبات ثانوية مسرطنة[10] تترافق مع عملية الكلور للمواد العضوية الموجودة طبيعيًا في الماء. وغاز ثاني أكسيد الكلور يتفوق على غاز الكلور عند العمل فوق pH 7،[11]:4-33 بوجود الأمونيا والأمينات[بحاجة لمصدر] و/أو من أجل ضبط الفيلم الحيوي في أنظمة توزيع الماء.[9] يستخدم غاز ثاني أكسيد الكلور في العديد من التطبيقات الصناعية لمعالجة المياه كمبيدات في أبراج التبريد ومعالجة المياه ومعالجة الطعام.[12]
المراجع
- قالب:CRC91
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (الطبعة الثانية). Butterworth-Heinemann. صفحات 844–849. ISBN 0-08-037941-9. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Brockway LO (1933). "The Three-Electron Bond in Chlorine Dioxide". Proc. Natl. Acad. Sci. U.S.A. 19 (3): 303–7. doi:10.1073/pnas.19.3.303. PMC 1085967. PMID 16577512. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Pauling, Linus (1988). General chemistry. Mineola, NY: Dover Publications, Inc. ISBN 0-486-65622-5. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Thomas Wilson Swaddle (1997). Inorganic chemistry: an industrial and environmental perspective. Academic Press. صفحات 198–199. ISBN 0126785503. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Seymour Stanton Block (2001). Disinfection, sterilization, and preservation (الطبعة 5th). Lippincott Williams & Wilkins. صفحة 215. ISBN 0-683-30740-1. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Sorlini, S.; Collivignarelli, C. (2005). "Trihalomethane formation during chemical oxidation with chlorine, chlorine dioxide and ozone of ten Italian natural waters". Desalination. 176 (1–3): 103–111. doi:10.1016/j.desal.2004.10.022. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Li J.; Yu Z.; Gao M. (1996). "A pilot study on trihalomethane formation in water treated by chlorine dioxide (translated from Chinese)". Zhonghua Yu Fang Yi Xue Za Zhi (Chinese journal of preventive medicine). 30 (1): 10–13. PMID 8758861. الوسيط
|CitationClass=تم تجاهله (مساعدة) - C. J. Volk; R. Hofmann; C. Chauret; G. A. Gagnon; G. Ranger; R. C. Andrews (2002). "Implementation of chlorine dioxide disinfection: Effects of the treatment change on drinking water quality in a full-scale distribution system". J. Environ. Eng. Sci. 1: 323–330. doi:10.1139/SO2-026. مؤرشف من الأصل (PDF) في 29 ديسمبر 2014. اطلع عليه بتاريخ 27 نوفمبر 2009. الوسيط
|CitationClass=تم تجاهله (مساعدة) - M. A. Pereira; L. H. Lin; J. M. Lippitt; S. L. Herren (1982). "Trihalomethanes as initiators and promoters of carcinogenesis". Environ Health Perspect. 46: 151–156. doi:10.2307/3429432. JSTOR 3429432. PMC 1569022. PMID 7151756. الوسيط
|CitationClass=تم تجاهله (مساعدة) - EPA Guidance Manual, chapter 4: Chlorine dioxide (PDF), US Environmental Protection Agency, مؤرشف من الأصل (PDF) في 14 يوليو 2015, اطلع عليه بتاريخ 27 نوفمبر 2009 الوسيط
|CitationClass=تم تجاهله (مساعدة); الوسيط|separator=تم تجاهله (مساعدة)CS1 maint: ref=harv (link) - Andrews, L.; Key, A.; Martin, R.; Grodner, R.; Park, D. (2002). "Chlorine dioxide wash of shrimp and crawfish an alternative to aqueous chlorine". Food Microbiology. 19 (4): 261–267. doi:10.1006/fmic.2002.0493. الوسيط
|CitationClass=تم تجاهله (مساعدة)
- بوابة الكيمياء



