ثلاثي ميثيل الزرنيخ
ثلاثي ميثيل الزرنيخ مركب كيميائي من مركبات الزرنيخ العضوية له الصيغة المجملة C3H9As، ويكتب أيضاً على الشكل CH3)3As)، ويرمز له AsMe3. ويكون على شكل سائل عديم اللون، له رائحة تشبه رائحة الثوم.
| ثلاثي ميثيل الزرنيخ | |
|---|---|
 ثلاثي ميثيل الزرنيخ | |
 ثلاثي ميثيل الزرنيخ | |
| الاسم النظامي (IUPAC) | |
ثلاثي ميثيل الزرنيخ | |
| المعرفات | |
| الاختصارات | AsMe3 |
| رقم CAS | 593-88-4 |
| بوب كيم | 68978 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| الخواص | |
| الصيغة الجزيئية | C3H9As |
| الكتلة المولية | 120.02 غ/مول |
| المظهر | سائل عديم اللون |
| الكثافة | 1.12 غ/سم3 |
| نقطة الانصهار | - 87.3 °س |
| نقطة الغليان | 51 °س |
| الذوبانية في الماء | ضعيف الانحلال |
| المخاطر | |
| ترميز المخاطر |  T T
 N N |
| توصيف المخاطر | |
| تحذيرات وقائية | |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
التاريخ
حضر ثلاثي ميثيل الزرنيخ لأول مرة عام 1854. وفي عام 1893 قام العالم الإيطالي بارتولوميو غوسيو Bartolomeo Gosio بنشر أبحاث تنص على أن بعض أنواع الفطريات يسمى Scopulariopsis brevicaulis التي تنمو على أوراق الجدران المتهالكة والمطلية بطلاء حاوي على الزرنيخ تقوم بإصدار غاز سام، أسماه غاز غوسيو Gosio gas، واكتشف لاحقاً أنه يحوي على ثلاثي ميثيل الزرنيخ.[3] تقوم هذه الفطريات باستقلاب الزرنيخ داخلها وتقوم بعملية مثـْيَلة فتنتج مركبات ميثيل الزرنيخ المختلفة.[4] كان الزرنيخ يدخل سابقاً في تركيب بعض أنواع الخضب مثل أخضر باريس وأخضر شيله.
على الرغم من ذلك، فإن بعض الدراسات الحديثة أظهرت أن ثلاثي ميثيل الزرنيخ له سمية ضعيفة نسبياً، قد لا تؤدي إلى حدوث الوفاة أو إلى حدوث الأعراض الصحية الخطيرة التي دونت في القرن التاسع عشر.[5] [6]
الخواص
- لا ينحل ثلاثي ميثيل الزرنيخ في الماء بشكل جيد في الماء، إنما بشكل جزئي، لكنه ينحل في أغلب المحلات العضوية.
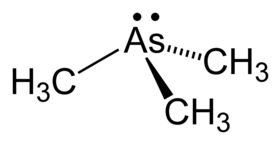
- حسب نظرية تنافر أزواج إلكترونات غلاف التكافؤ VSEPR theory، فإن لثلاثي ميثيل الزرنيخ بنية هرمية، تكون فيها أبعاد الرابطة As-C زرنيخ-كربون 1.519 Å، أما الزاوية C-As-C فتبلغ 91.83°.[7]
- يتأكسد ثلاثي ميثيل الزرنيخ بأكسجين الهواء ليعطي ثلاثي ميثيل أكسيد الزرنيخ حسب المعادلة:
- AsMe3 + 1/2 O2 → OAsMe3
الوفرة الطبيعية والتحضير
ينتج ثلاثي ميثيل الزرنيخ كناتج لعملية استقلاب الزرنيخ في البكتريا والفطريات. تحدث هذه العملية طبيعياً في الصخور والأتربة الحاوية على تراكيز منخفضة من الزرنيخ تصل إلى مستويات جزء في المليون.[8] وجدت آثار بتراكيز منخفضة جداً (جزء في البليون) من ثلاثي ميثيل الزرنيخ في الغازات الناتجة عن مراكز ردم النفايات في ألمانيا وكندا والولايات المتحدة، حيث كان AsMe3 المركب الأساسي الحاوي على الزرنيخ في ذلك الغاز.[9][10] [11]
يحضر ثلاثي ميثيل الزرنيخ مخبرياً من تفاعل أكسيد الزرنيخ الثلاثي مع ثلاثي ميثيل الألومنيوم:[12]
- As2O3 + 1.5 [AlMe3]2 → 2 AsMe3 + 3/n (MeAl-O)n
السلامة
يعد ثلاثي ميثيل الزرنيخ من المركبات الخطرة.[13][14][15] مع أن البعض يعتبر أن خطورته مهولة أكثر مما هي عليه.[5]
تنشأ خطورة التسمم بمركبات الزرنيخ العضوية من تفاعلها مع البروتينات الحاوية على الكبريت في الجسم، مما ينتج عنه تعطيل دورة حمض الستريك، بالإضافة إلى توقف عملية فسفرة على مستوى الركازة Substrate-level phosphorylation في عملية التحلل السكري.[16][17]
المراجع
- معرف بوب كيم: https://pubchem.ncbi.nlm.nih.gov/compound/68978 — تاريخ الاطلاع: 5 أكتوبر 2016 — العنوان : Trimethylarsine — الرخصة: محتوى حر
- معرف بوب كيم: https://pubchem.ncbi.nlm.nih.gov/compound/68978
- Frederick Challenger (1955). "Biological methylation". Q. Rev. Chem. Soc. 9: 255–286. doi:10.1039/QR9550900255. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Ronald Bentley and Thomas G. Chasteen (2002). "Microbial Methylation of Metalloids: Arsenic, Antimony, and Bismuth". Microbiology and Molecular Biology Reviews. 66 (2): 250–271. doi:10.1128/MMBR.66.2.250-271.2002. PMC 120786. PMID 12040126. الوسيط
|CitationClass=تم تجاهله (مساعدة) - William R. Cullen, Ronald Bentley (2005). "The toxicity of trimethylarsine: an urban myth". J. Environ. Monit. 7 (1): 11–15. doi:10.1039/b413752n. PMID 15693178. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Frederick Challenger, Constance Higginbottom, Louis Ellis (1933). "The formation of organo-metalloidal compounds by microorganisms. Part I. Trimethylarsine and dimethylethylarsine". J. Chem. Soc.: 95–101. doi:10.1039/JR9330000095. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Wells, A.F. (1984). Structural Inorganic Chemistry, fifth edition. Oxford University Press. ISBN 0198553706. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Cullen, W.R., Reimer, K.J. (1989). "Arsenic speciation in the environment". Chem. Reviews. 89: 713–764, . doi:10.1021/cr00094a002. الوسيط
|CitationClass=تم تجاهله (مساعدة)CS1 maint: extra punctuation (link) صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Feldmann, J., Cullen, W.R. (1997). "Occurrence of Volatile Transition Metal Compounds in Landfill Gas: Synthesis of Molybdenum and Tungsten Carbonyls in the". Environ. Sci. Technol. 31: 2125–2129. doi:10.1021/es960952y. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Pinel-Raffaitin, P., LeHecho, I., Amouroux, D., Potin-Gautier, M. (2007). "Distribution and Fate of Inorganic and Organic Arsenic Species in Landfill Leachates and Biogases". Environ. Sci. Technol. 41 (13): 4536–4541. doi:10.1021/es0628506. PMID 17695893. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Khoury, J.T.; et al. (April 7, 2008). "Analysis of Volatile Arsenic Compounds in Landfill Gas". Odors & Air Emissions 2008. Phoenix, Arizona: Water Environment Federation. الوسيط
|CitationClass=تم تجاهله (مساعدة); Explicit use of et al. in:|author=(مساعدة) - V. V. Gavrilenko, L. A. Chekulaeva, and I. V. Pisareva, "Highly efficient synthesis of trimethylarsine" Izvestiya Akademii Nauk. Seriya Khimicheskaya, No. 8, pp. 2122–2123, 1996.
- Andrewes, Paul; et al. (2003). "Dimethylarsine and Trimethylarsine Are Potent Genotoxins In Vitro". Chem. Res. Toxicol., 16 (8), 994 -1003, 2003. الوسيط
|CitationClass=تم تجاهله (مساعدة); Explicit use of et al. in:|مؤلف=(مساعدة) - Irvin, T.Rick; et al. (1995). "In-vitro Prenatal Toxicity of Trimethylarsine, Trimethylarsine Oxide and Trimethylarsine Sulfide". Applied Organometallic Chemistry. Vol. 9.315-321. الوسيط
|CitationClass=تم تجاهله (مساعدة); Explicit use of et al. in:|مؤلف=(مساعدة) - Hiroshi Yamauchi, Toshikazu Kaise, Keiko Takahashi, Yukio Yamamura (1990). "Toxicity and metabolism of trimethylarsine in mice and hamsters". Fundamental and Applied Toxicology. 14 (2): 399–407. doi:10.1016/0272-0590(90)90219-A. PMID 2318361. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Ronald Bentley & Thomas G. Chasteen (2002): Microbial Methylation of Metalloids: Arsenic, Antimony, and Bismuth. In: Microbiol. Mol. Biol. Rev. Bd. 66, S. 250–271. ببمد 12040126 PDF نسخة محفوظة 20 أبريل 2020 على موقع واي باك مشين.
- Jutta Kresimon: Untersuchung humaner Körperflüssigkeiten und Ausscheidungsprodukte auf metall- und metalloidorganische Verbindungen mittels HG/LT-GC/ICP-MS. Dissertation. Essen, 2002 نسخة محفوظة 21 سبتمبر 2011 على موقع واي باك مشين.
- بوابة الكيمياء
 صور وملفات صوتية من كومنز
صور وملفات صوتية من كومنز