ثلاثي فلوريد الكلور
ثلاثي فلوريد الكلور هو مركب كيميائي من المركبات بين الهالوجينية يتكون من عنصري الفلور والكلور، وله الصيغة ClF3، ويكون على شكل غاز عديم اللون.
| ثلاثي فلوريد الكلور | |
|---|---|
 ثلاثي فلوريد الكلور |
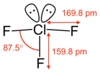 ثلاثي فلوريد الكلور |
| تسمية الاتحاد الدولي للكيمياء | |
Trifluoro-λ3-chlorane[1] | |
| المعرفات | |
| رقم CAS | 7790-91-2 |
| بوب كيم (PubChem) | 24637 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| الخواص | |
| الصيغة الجزيئية | ClF3 |
| الكتلة المولية | 92.45 غ/مول |
| المظهر | غاز عديم اللون |
| الكثافة | 3.57 غ/سم3 |
| نقطة الانصهار | 76.31 °س |
| نقطة الغليان | 11.8 °س |
| الذوبانية في الماء | يتفاعل بعنف [4] |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
يعد غاز ثلاثي فلوريد الكلور من الغازات السامة وله رائحة واخزة، ونشاط كيميائي كبير.
التحضير
يحضر ثلاثي فلوريد الكلور من التفاعل المباشر بين عنصري الفلور والكلور عند درجات حرارة تبلغ حوالي 400 °س.[5]
الخواص
يتفاعل ثلاثي فلوريد الكلور بعنف مع الماء ومع المذيبات العضوية.[5]
يعد ثلاثي فلوريد الكلور من المؤكسدات القوية، حيث يتفاعل مع الفلزات ليشكل الفلوريدات الموافقة. يتعلق مدى استمرار التفاعل على نوعية المادة، ففي الفلزات يشكل طبقة عازلة من الفلوريد، كما هو الحال مع النحاس، والتي تحول دون استمرار التفاعل؛ أما مع اللافلزات فلا تتشكل طبقة عازلة، إنما يستمر بالتفاعل على شكل اشتعالي. يتفاعل المركب مع الزجاج، لذلك تجرى التفاعلات الكيميائية لثلاثي فلوريد الكلور في أوعية مصنوعة من النحاس.
الاستخدامات
يستخدم ثلاثي فلوريد الكلور بشكل رئيسي في عمليات الفلورة بشكل عام، وفي تحضير سداسي فلوريد اليورانيوم بشكل خاص.[6]
لمركب ثلاثي فلوريد الكلور تطبيقات في مجالات مختلفة، منها استخدامه كمكوّن في وقود الصواريخ؛ وفي صناعة أشباه الموصلات وذلك في عمليات التنظيف الخالية من البلازما وفي عمليات التنميش؛[7][8] وكذلك في المجالات النووية في عمليات إعادة معالجة الوقود النووي.[9]
احتياطات الأمان
ثلاثي فلوريد الكلور مركب سام ومخرش ومؤكسد قوي، لذا يجب أخذ الحيطة والحذر مع اتباع إجراءات السلامة الضرورية عند التعامل به.
طالع أيضاً
المراجع
- "Chlorine trifluoride - Compound Summary". PubChem Compound. USA: National Center for Biotechnology Information. 16 September 2004. Identification and Related Records. مؤرشف من الأصل في 22 فبراير 2014. اطلع عليه بتاريخ 09 أكتوبر 2011. الوسيط
|CitationClass=تم تجاهله (مساعدة) - معرف بوب كيم: https://pubchem.ncbi.nlm.nih.gov/compound/24637 — تاريخ الاطلاع: 20 نوفمبر 2016 — العنوان : CHLORINE TRIFLUORIDE — الرخصة: محتوى حر
- معرف بوب كيم: https://pubchem.ncbi.nlm.nih.gov/compound/24637
- Chlorine fluoride (ClF3) at Guidechem Chemical Networkنسخة محفوظة 03 مارس 2016 على موقع واي باك مشين.
- Georg Brauer: Handbuch der Präparativen Anorganischen Chemie. 3., umgearb. Auflage. Band I. Enke, Stuttgart 1975, ISBN 3-432-02328-6, p. 168.(بالألمانية)
- Chlorfluoride. In: Römpp Online. Georg Thieme Verlag
- Hitoshi Habuka; Takahiro Sukenobu; Hideyuki Koda; Takashi Takeuchi; Masahiko Aihara (2004). "Silicon Etch Rate Using Chlorine Trifluoride". Journal of the Electrochemical Society. 151 (11): G783–G787. doi:10.1149/1.1806391. الوسيط
|CitationClass=تم تجاهله (مساعدة) - United States Patent 5849092 "Process for chlorine trifluoride chamber cleaning" [وصلة مكسورة] نسخة محفوظة 05 فبراير 2012 على موقع واي باك مشين.
- Board on Environmental Studies and Toxicology, (BEST) (2006). Acute Exposure Guideline Levels for Selected Airborne Chemicals: Volume 5 [https://www.nap.edu/catalog/11774/acute-exposure-guideline-levels-for-selected-airborne-chemicals-volume-5 (citation at the National Academies Press)]. Washington D.C.: National Academies Press. صفحة 40. ISBN 0-309-10358-4. مؤرشف من الأصل في 7 نوفمبر 2014. اطلع عليه بتاريخ 31 يوليو 2016. الوسيط
|CitationClass=تم تجاهله (مساعدة); روابط خارجية في|title=(مساعدة)
- بوابة الفضاء
- بوابة رحلات فضائية
- بوابة الكيمياء
