ثلاثي أكسيد الفوسفور
ثلاثي أكسيد الفوسفور (أو أكسيد الفوسفور الثلاثي) هو أكسيد لعنصر الفوسفور الثلاثي صيغته P4O6، ويوجد في الشروط القياسية على شكل بلورات صلبة عديمة اللون.
| ثلاثي أكسيد الفوسفور | |
|---|---|
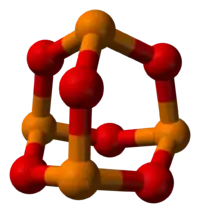 الفوسفور بالبرتقالي والأكسجين بالأحمر الفوسفور بالبرتقالي والأكسجين بالأحمر | |
 ثلاثي أكسيد الفوسفور | |
| المعرفات | |
| CAS | 12440-00-5، و10248-58-5 |
| بوب كيم | 123290 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| الخواص | |
| الصيغة الجزيئية | P4O6 |
| الكتلة المولية | 219.88 غ/مول |
| المظهر | بلورات صلبة عديمة اللون |
| الكثافة | 2.13 غ/سم3 |
| نقطة الانصهار | 24 °س |
| نقطة الغليان | 175 °س |
| الذوبانية في الماء | يتفاعل |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
للمركب بنية ذات هيكل مشابه لهيكل الأدامانتان، وهو من المركبات السامة.
التحضير
يحضر المركب من بالتفاعل المباشر لعنصر الفوسفور مع الأكسجين وفق المعادلة:
يمكن أن يتشكل تحت أكسيد الفوسفور ناتجاً ثانوياً للتفاعل.[3]
الخواص
يوجد المركب في الشروط القياسية على شكل بلورات عديمة اللون،[3] وهي سهلة الانصهار، لكنها تتفاعل مع الماء لتعطي حمض الفوسفوروز:
بحيث يمكن القول أن هذا الأكسيد هو أنهيدريد (بلا ماء) لهذا الحمض.[4] كما تسهل أكسدة هذا المركب إلى الأكسيد الأعلى من خماسي أكسيد الفوسفور:
يؤدي تفاعل هذا الأكسيد مع كلوريد الهيدروجين إلى الحصول على حمض الفوسفوروز بالإضافة إلى ثلاثي كلوريد الفوسفور:
في حين أن التفاعل المباشر مع الهالوجينات مثل الكلور والبروم يعطي هاليدات الفوسفوريل الموافقة، مثل كلوريد الفوسفوريل وبروميد الفوسفوريل، على الترتيب. أما التفاعل مع اليود في أنبوب محكم الإغلاق يعطي مركب رباعي يوديد ثتائي الفوسفور.[3]
يتفاعل ثلاثي أكسيد الفوسفور مع الأوزون عند درجة حرارة مقدارها 195 كلفن ليعطي مركب P4O18 غير المستقر.[5]
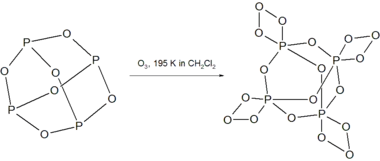
يؤدي تسخين ثلاثي أكسيد الفوسفور P4O6 في أنبوب محكم الإغلاق إلى الدرجة 710 كلفن إلى حدوث تفاعل عدم تناسب، بحيث يستحصل على الأكسيد المختلط P4O8 بالإضافة إلى الفوسفور الأحمر.[5]
يمكن أن يدخل هذا المركب ربيطة في بعض المعقدات التناسقية مثلما الحال مع رباعي كربونيل الحديد P4O6·Fe(CO)4.[6] أما مع البوران فهو يشكل ناتج ضم ثنائي الوحدات.[5]
طالع أيضاً
مراجع
- معرف بوب كيم: https://pubchem.ncbi.nlm.nih.gov/compound/123290 — تاريخ الاطلاع: 6 أكتوبر 2016 — العنوان : Tetraphosphorus hexaoxide — الرخصة: محتوى حر
- معرف بوب كيم: https://pubchem.ncbi.nlm.nih.gov/compound/123290
- A. F. Holleman; Wiberg, Egon; Wiberg, Nils (2001). Inorganic Chemistry. Boston: Academic Press. ISBN 0-12-352651-5. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (الطبعة الثانية). Butterworth-Heinemann. ISBN 0-08-037941-9. الوسيط
|CitationClass=تم تجاهله (مساعدة) - .Catherine E. Housecroft; Alan G. Sharpe (2008). "Chapter 15: The group 15 elements". Inorganic Chemistry, 3rd Edition. Pearson. صفحة 473. ISBN 978-0-13-175553-6. الوسيط
|CitationClass=تم تجاهله (مساعدة) - M. Jansen & J. Clade (November 1996). "Tetracarbonyl(tetraphosphorus hexaoxide)iron". Acta Crystallogr. C. 52 (11): 2650–2652. doi:10.1107/S0108270196004398. الوسيط
|CitationClass=تم تجاهله (مساعدة)
- بوابة الكيمياء
 صور وملفات صوتية من كومنز
صور وملفات صوتية من كومنز
