توازن بودوارد
توازن بودوارد في الكيمياء (بالإنجليزية: Boudouard equilibrium) هو توازن كيميائي مسمى باسم مكتشفه "أوكتاف بودوارد" (1872–1923) . يحدث هذا التوازن بين ثاني أكسيد الكربون
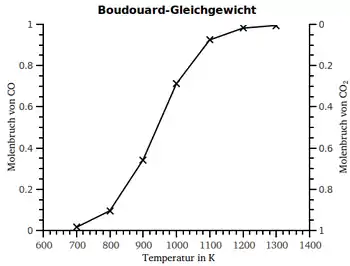
(CO2) و أول أكسيد الكربون (CO), عند تفاعل ثاني أكسيد الكربون مع الكربون المتوهج . فقد لاحظ أن توازن التفاعل ينزاح بسبب درجة الحرارة العالية لهذا التفاعل الماص للحرارة في اتجاه إنتاج أول أكسيد الكربون (CO), ولكن مع زيادة الضغط ينزاح التوازن في اتجاه المواد الداخلة في التفاعل ، حيث تقل عدد جزيئات الغاز . (انظر مبدأ لو شاتيليه) .
التفاعل:
تكون سرعة التفاعل صغيرة جدا عند درجة حرارة الغرفة ، حيث يكون أول أكسيد الكربون شبه مستقر .
يستخدم هذا التفاعل في عملية تحويل الفحم إلى غاز لاستغلاله في إنتاج الطاقة بدلا من الغاز الطبيعي ، ويشكل هذا التفاعل أيضا إحدى المراحل الهامة في عملية اختزال أكسيد الحديد في الأفران العالية.
- ملحوظة : عملية تحويل الفحم إلى غاز هي عملية عالية التكاليف ولا تصلح حتى الآن للاستخدام الصناعي بسبب تكلفتها العالية ، ولكن لجأت إليها ألمانيا خلال الحرب العالمية الثانية لافتقارها في الحصول على النفط من الخارج بسبب حصار الحلفاء لها ، واضطرت لهذه الطريقة الباهظة الثمن لتزويد طائراتها ومصفحاتها بالوقود .
| درجة الحرارة in °C | CO2 in % | CO in % |
| 450 | 98 | 2 |
| 600 | 77 | 23 |
| 700 | 42 | 58 |
| 800 | 6 | 94 |
| 900 | 3 | 97 |
| 1000 | 1 | 99 |
| توازن بودوارد عند ضغط105 Pa | ||
اقرأ أيضا
المراجع
- David R. Lide (2009) (in German), CRC Handbook of Chemistry and Physics (90. ed.), Taylor & Francis, ISBN 978-1-4200-9084-0
- Atkins: Physikalische Chemie, VCH, 2.Auflage 1996
- بوابة الفيزياء
- بوابة كيمياء فيزيائية
- بوابة الكيمياء