تفاعل مطلق للطاقة
التفاعل المطلق للطاقة هو تفاعل كيميائي يكون فيه التغير في الطاقة الحرة سلبياً (هناك إطلاق صافي للطاقة الحرة)، وهذا يشير إلى تفاعل عفوي. بالنسبة للعمليات التي تتم تحت ظروف الضغط ودرجة الحرارة الثابتة يتم استخدام طاقة غيبس الحرة في حين يتم استخدام طاقة هلمهولتز الحرة في العمليات التي تتم تحت ظروف الحجم ودرجة الحرارة الثابتة.[1]
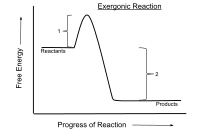
رمزيا يطلق على الطاقة الحرة (G) في تفاعل الطاقة (عند الضغط المستمر ودرجة الحرارة):
على الرغم من أن تفاعلات الطاقة الذرية تحدث بشكل تلقائي إلا أن هذا لا يعني أن التفاعل سيحدث بمعدل ملحوظ. على سبيل المثال فإن عدم تناسق بيروكسيد الهيدروجين بطيء جدا في غياب محفز مناسب.
وبصورة أعم فإن المصطلحين الخارجين عن الطاقة والقدرة على تحمل الطاقة الكهربائية يرتبطان بتغير الطاقة الحر في أي عملية وليس فقط التفاعلات الكيميائية.[2]
مثال على رد فعل الطاقة هو التنفس الخلوي. هذا يتعلق بدرجات الحرية نتيجة للإنتروبيا ، ودرجة الحرارة والفرق في الحرارة المنطلقة أو الممتصة.
وعلى النقيض من ذلك فإن المصطلحات الطاردة للحرارة واللامدة للحرارة تتعلق بالتبادل الكلي للحرارة أثناء العملية.
مراجع
- IUPAC Gold Book definition: exergonic (exoergic) reaction
- Hamori, Eugene; James E. Muldrey (1984). "Use of the word "eager" instead of "spontaneous" for the description of exergonic reactions". Journal of Chemical Education. 61 (8): 710. Bibcode:1984JChEd..61..710H. doi:10.1021/ed061p710.
- بوابة الفيزياء
- بوابة الكيمياء
- بوابة الكيمياء الحيوية
- بوابة طاقة
- بوابة كيمياء فيزيائية
