تذاوب
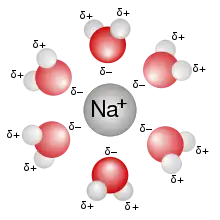
التذاوب [1] في الكيمياء هو وصف لعملية تحدث في وسط المحلول عندما تتجاذب جزيئات المذيب وتترافق مع جزيئات أو أيونات المادة المراد إذابتها. أو بشكل آخر، عندما تنحل الأيونات فيمذيب ما فإنها تتفرق عن بعضها وتحاط بجزيئات المذيب (أو المُحلّ). توصف عملية إحاطة جزيئات المذيب لتلك الأيونات باسم التذاوب.
التعريف
حسب الاتحاد الدولي للكيمياء البحتة والتطبيقية (IUPAC) فإن التذاوب يعرّف كالتالي:[2] هو عملية تآثر المادة المذابة مع المذيب، والتي تقود إلى حدوث ثباتية (ترموديناميكية) للأنواع الكيميائية الخاصة بالمادة المذابة في المحلول. تتضمن هذه التآثرات وجود قوى كهربائية ساكنة (إلكتروستاتيكية) وقوى فان دير فالس، بالإضافة إلى تأثيرات كيميائية خاصة مثل تشكل الروابط الهيدروجينية.
قد يتداخل مفهوم التذوب ظاهرياً مع مفهوم الإذابة ولكنه مختلف عنه. إن مفهوم الإذابة هو وصف عملية حركية كيميائية، في حين أن الانحلالية (أو الذائبية) تحدد كمياً حالة التوازن الديناميكي عندما يساوي معدل الإذابة معدل الترسيب.
المراجع
- ترجمة Solvation حسب بنك باسم للمصطلحات العلمية؛ مدينة الملك عبد العزيز للعلوم والتقنية، تاريخ الوصول: 05 02 2017.
- IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997) نسخة محفوظة 19 ديسمبر 2016 على موقع واي باك مشين.
- بوابة الكيمياء
