تدفق الغازات
التدفق في فيزياء بالنسبة للغازات يقصد به العملية التي من خلالها تعبر الجسيمات فتحة صغيرة أبعادها أصغر من المسار الحر الوسطي لجزيئات الغاز.[1] حسب قانون غراهام فإن معدل تدفق الغازات يتناسب مع الكتلة المولية، مما يعني أن الغازات التي لها وزن جزيئي أكبر تتدفق بشكل أبطأ من الغازات التي لها وزن جزيئي منخفض.
- Rate1: معدل تدفق الغاز 1
- Rate2: معدل تدفق الغاز 2
- M1: الكتلة المولية للغاز 1
- M2: الكتلة المولية 2
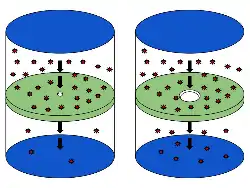
الصورة على اليسار تمثل التدفق في حين أن الصورة على اليمين تمثل الانتشار. يحث التدفق عندما تستطيع الجسيمات عبور فتحة أصغر من المسار الحر الوسطي عند الحركة، في حين أن الانتشار يحدث من خلال إمكانية عبور جسيمات عدة في نفس الوقت.
إذا اعتبرنا غازين لهما نفس درجة الحرارة بالتالي يمكن اعتبار أن لهما نفس الطاقة الحركية فإن المسار الحر الوسطي لكل غاز يمكن حسابه من المعادلة:
حيث عبارة عن ثابت بولتزمان.
مما يعني، أن الغازات الأخف لها سرعة أكبر، أي ان عدد الجزيئات التي تمر من فتحة صغيرة يكون أكبر. لذلك فإنه عند إجراء عملية إفراغ لبالونين أحدهما يحوي غاز الهيدروجين والأخر غاز الأكسجين، فإن البالون الحاوي على الهيدروجين يفرغ بسرعة أكبر.
المراجع
- K.J. Laidler and J.H. Meiser, Physical Chemistry, Benjamin/Cummings 1982, p.18
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.
