بنزل
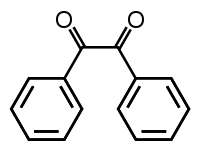
البنزل مركب عضوي صيغته الكيميائية (C6H5CO)2 ويختصر عموماً بـ (PhCO)2، ويكون على شكل بلورات صفراء اللون، وهو من أكثر الكيتونات الثنائية شيوعاً، ويستعمل بشكل رئيسي كبادئ ضوئي في كيمياء البوليمرات.[3]
| بنزل | |
|---|---|
 بنزل | |
 بنزل | |
 بنزل | |
| الاسم النظامي (IUPAC) | |
1,2-diphenylethane-1,2-dione | |
| المعرفات | |
| رقم CAS | 134-81-6 |
| بوب كيم (PubChem) | 8651 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| |
| الخواص | |
| صيغة كيميائية | C14H10O2 |
| كتلة مولية | 210.23 غ.مول−1 |
| المظهر | yellow crystals or powder |
| الكثافة | 1.23 g/cm3, solid (1.255 g/cm3, x-ray) |
| نقطة الانصهار | 94-96 °C, 201.2–204.8 °F, 367.15-369.15 K |
| نقطة الغليان | 346–348 °C, 654.8–658.4 °F, 619–621 K |
| الذوبانية في الماء | غير ذائب |
| الذوبانية في بنزين | ذائب |
| البنية | |
| البنية البلورية | P31,221[1] |
| عزم جزيئي ثنائي القطب | 3.8 ديباي[2] |
| المخاطر | |
| مخاطر | مهيج |
| NFPA 704 |
1
2
0
|
| مركبات متعلقة | |
| ثنائي كيتونs ذات علاقة | biacetyl |
| مركبات ذات علاقة | بنزوفينون كلايوكسال bibenzil |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
البنية
أهم الميزات البنيوية في تركيب البنزل هو رابطة كربون-كربون الطويلة (1.54 Å) والذي يدل على غياب الآصرة باي بين مركزي الكاربونيل في المركب. تكون مراكز PhCO مستوية، ولكن تكون مجموعتا البنزل ملتويتين بالنسبة لبعضهما البعض بزاوية زوجية قدرها 117°.[4] وفي المركبات المشابهة للبنزل وذات الإعاقة الفراغية الأقل مثل (الكلايكوسال، ثنائي الأسيتال، مشتقات حمض الأكساليك) تتخذ مجموعة (RCO)2 تركيباً مستوياً مضاداً.
الاستخدامات
يستخدم بشكل رئيسي في التقسية بالجذور الحرة لشبكات البوليمر، حيث يتفكك البنزل بواسطة الأشعة فوق البنفسجية، منتجاً أصنافاً من الجذور الحرة ضمن المادة، محفزاً التشابك. وقد وُصف البنزل حديثاً كمثبط فعال للكاربوكسيل استيريز البشري، والإنزيمات المشتركة في التحلل المائية للاسترات الكربوكسيلية، والعديد من الأدوية المستخدمة طبياً.[5]
التفاعلات
يعد البنزل مادة أساسية في التكوين العضوي، حيث يتكاثف مع الأمينات ليعطي ليكندات ثنائي الكيتيمين. أحد التفاعلات العضوية الكلاسيكية للبنزل هو إعادة ترتيب حمض البنزيليك، حيث تحفز القاعدة تحويل البنزل إلى حمض البنزيليك، ويستغل هذا التحول في تحضير عقار الفينيتوين. ويتفاعل البنزل أيضاً مع 1،3-ثنائي فنيل الأسيتون عبر تكاثف الألدول ليعطي رباعي فينيل البنتان دايون الحلقي.
التحضير
يحضر البنزل من البنزوين والذي يحضر بدوره من البنزلديهيد بواسطة تكاثف البنزوين.[6]
المراجع
- Acta Cryst. B43 398 (1987)
- Spectrochim. Acta A60 (8-9) 1805 (2004)
- Hardo Siegel, Manfred Eggersdorfer "Ketones" in Ullmann's Encyclopedia of Industrial Chemistry Wiley-VCH, 2002 by Wiley-VCH, Weinheim. doi:10.1002/14356007.a15_077
- Quang. Shen, Kolbjoern. Hagen "Gas-phase molecular structure and conformation of benzil as determined by electron diffraction" J. Phys. Chem., 1987, 91 (6), pp 1357–1360. doi:10.1021/j100290a017.
- Wadkins. R. M. et al "Identification and characterization of novel benzil (diphenylethane-1,2-dione) analogues as inhibitors of mammalian carboxylesterases. J. Med. Chem., 2005 48 pp 2906-15.
- Clarke, H. T.; Dreger.E. E.(1941)."Benzil". Org. Synth.; Coll. Vol. 1: 87.
- بوابة الكيمياء
