بروميد الذهب الثلاثي
بروميد الذهب الثلاثي أو ثلاثي بروميد الذهب هو مركب كيميائي له الصيغة المجملة AuBr3، لكنه غالبا ما يوجد على شكل متماثر ثنائي (ديمير) Au2Br6، ترتبط فيه ذرتا الذهب بواسطة ذرتي بروم (رابطة جسرية).[4][5][6] يكون المركب على شكل بلورات حمراء غامقة إلى سوداء.[4][5][7]
| بروميد الذهب الثلاثي | |
|---|---|
 بروميد الذهب الثلاثي | |
 بروميد الذهب الثلاثي | |
| الاسم النظامي (IUPAC) | |
بروميد الذهب الثلاثي | |
| المعرفات | |
| رقم CAS | 10294-28-7 |
| بوب كيم | 82525 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| الخواص | |
| الصيغة الجزيئية | AuBr3 |
| الكتلة المولية | 436.69 غ/مول |
| المظهر | بلورات حمراء غامقة إلى سوداء |
| نقطة الانصهار | 97.5 °س |
| المخاطر | |
| ترميز المخاطر |  C C |
| توصيف المخاطر | |
| تحذيرات وقائية | |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
كما هي الحال في هاليدات الذهب الأخرى، فإن هذا المركب يعد فريداً لكونه أحد المعقدات التساندية لأحد عناصر المجموعة الحادية عشر الانتقالية ولديه رقم أكسدة +3، في حين أن معقدات النحاس أو الفضة توجد في حالة الأكسدة +1 أو +2.[8]
البنية والخواص
يوجد المتماثر الثنائي لبروميد الذهب على شكل تساندي له بنية جزيئية مربعة مستوية، تكون فيه زوايا الروابط الكيميائية حوالي 90 درجة.[5][6]
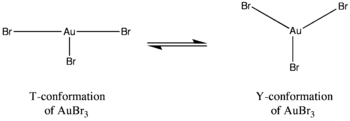
تشير الحسابات إلى وجود عوامل تؤثر في الشكل الافتراضي لمونوميرات هاليدات الفضة بشكل عام، فتوجد فروقات في البنية نتيجة تأثير جان-تيلر Jahn–Teller effect. فعلى سبيل المثال، يكون في بروميد الذهب الثلاثي ثلاث روابط ذهب-بروم، تكون اثنتان منهما قصيرة وواحدة طويلة، بالمقابل فإن كلوريد وفلوريد الذهب الثلاثي لديهما رابطتين طويلتين وواحدة قصيرة من الرابطة ذهب-هالوجين.[6] بالإضافة إلى ذلك فإن هناك اختلاف في البنية، حيث أن كلاً من فلوريد وكلوريد الذهب لديهما شكل تساندي على الشكل T، في حين أن بروميد الذهب لديه توازن ديناميكي بين الشكلين T و Y. يعزى هذا الفرق إلى تأثير جان-تيلر، وإلى ضعف ارتباط π العكسي بين ذرة الذهب المركزية وربيطة البروم مقارنة مع ربيطات الفلور والكلور، مما يفسر كون بروميد الذهب أقل ثباتاً من نظيريه.[6]
لم يعزل بروميد الذهب الثلاثي في الحالة الغازية، مام يشير إلى أن العدد التساندي 3 ليس مفضلاً عن غيره.[8][9] فكما ذكر في الأعلى فإن بروميد الذهب يفضل العدد التساندي 4 بحيث تكون له بنية مربعة مستوية.[5]
ويكون هذا الأمر واضحاً في المحاليل المائية لبروميد الذهب، حيث يظهر هنالك نزعة واضحة لتشكيل معقدات لهاليدات الذهب يكون فيها العدد التساندي 4، خاصة عندما يكون الهاليد على شكل هيدرات AuBr3 ⋅ H2O. وفي حال وجودها بشكل لا مائي تميل المركبات كما ذكر أيضاً إلى الارتباط مع نفسها وتشكيل متماثرات ثنائية [8]
- 2AuBr3 → Au2Br6
أو أن يقوم بالارتباط مع مركبات أخرى لتشكيل معقدات خاصة أن المركب من حموض لويس.[9] فعلى سبيل المثال، بوجود حمض هيدروبروميك فإن المتماثر الثنائي (ديمير) ينحل مشكلاً bromoauric acid حمض بروم الذهبيك [5]
HBr(aq) + AuBr3(aq) → H+AuBr4−(aq)
التحضير
يحضر بروميد الذهب الثلاثي من تسخين فلز الذهب بوجود فائض من البروم عند الدرجة 140°س.[7]
- 2Au + 3Br2 (140 °C) → Au2Br6
أو يحضر بتفاعل استبدال الربيطات بمعالجة كلوريد الذهب الثلاثي مع حمض هيدروبروميك حسب المعادلة:
- Au2Cl6 + 6HBr → 6HCl + Au2Br6
إن العامل الذي يدفع التفاعل أعلاه للحدوث هو تشكل حمض هيدروكلوريك HCl الأكثر ثباتاً من حمض هيدروبروميك.[10]
الاستخدامات
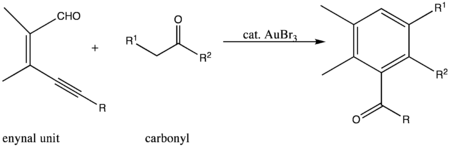
يستخدم بروميد الذهب الثلاثي كحفاز في العديد من التفاعلات العضوية، أبرزها تفاعل ديلز-ألدر عموماً، وعلى الخصوص التفاعل بين مركبات الإينينال enynal والكربونيل لتشكيل المركبات الحلقية السداسية.[11]
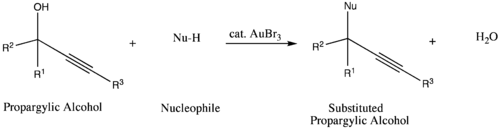
من أنواع التفاعلات الأخرى التي تستخدم بروميد الذهب الثلاثي كحفاز هي تفاعلات الاستبدال المحبة للنواة لكحولات البروبارجيليك propargylic، حيث يقوم الذهب بدور تنشيط الكحول لتسهيل تفاعل الاستبدال.[12]
المراجع
- معرف بوب كيم: https://pubchem.ncbi.nlm.nih.gov/compound/82525 — تاريخ الاطلاع: 5 أكتوبر 2016 — العنوان : Gold bromide (AuBr3) — الرخصة: محتوى حر
- معرف المكون الفريد: https://fdasis.nlm.nih.gov/srs/unii/4PJV3VH75Y — تاريخ الاطلاع: 14 فبراير 2018 — المحرر: إدارة الأغذية والأدوية — العنوان : Unique Ingredient Identifier
- Gold(III) bromide 99.9% trace metals basis | Sigma-Aldrich نسخة محفوظة 11 فبراير 2012 على موقع واي باك مشين.
- Greenwood, N.N.; Earnshaw, A. Chemistry of the Elements; Butterworth-Heineman: Oxford,1997; pp. 1183-1185
- Cotton, F.A.; Wilkinson, G.; Murillo, C.A.; Bochmann, M. Advanced Inorganic Chemistry; John Wiley & Sons: New York, 1999; pp. 1101-1102
- Schulz, A.; Hargittai, M. Chem. Eur. J. 2001, vol. 7, pp. 3657-3670
- Macintyre, J. E. (ed.) Dictionary of Inorganic Compounds; Chapman & Hall: London, 1992; vol. 1, pp. 121
- Schwerdtfeger, P. J. Am. Chem. Soc. 1989, vol. 111, pp. 7261-7262
- Schwerdtfeger, P.; Boyd, P.D.W.; Brienne, S.; Burrell, K. Inorg. Chem. 1992, vol. 31, pp. 3411-3422
- Dell'Amico, D.B.; Calderazzo, F.; Morvillo, A.; Pelizzi, G; Robino, P. J. Chem. Soc. Dalton Trans. 1991, pp. 3009-3016
- Asao, N.; Aikawa, H.; Yamamoto, Y. J. Am. Chem. Soc. 2004, vol. 126, pp. 7458-7459
- Georgy, M.; Boucard, V.; Campagne, J. J. Am. Chem. Soc. 2005, vol. 127, pp. 14180-14181
- بوابة الكيمياء