بروتين سكري-P
البروتين السكري-P أو البروتين السكري-بّي (البروتين السكري النفوذ) يعرف أيضًا بالبروتين المقاوم الدوائي المتعدد 1 (MDR1) أو العضو 1 من عائلة الفرعية كاسيت الرابطة لل ATP (ABCB1) أو عنقود التمييز 243 (CD243)، هو بروتين مهم للأغشية الخلوية يضخ الكثير من المواد الغريبة إلى خارج الخلايا. وهو مضخة تدفق معتمدة على الـ ATP ذات نوعية عالية للركيزة. توجد لدى الحيوانات، والفطور، والجراثيم، ومن المحتمل أن تكون قد تطورت كآلية دفاعية ضد المواد الضارة.
| ATP binding cassette subfamily B member 1 | |||||||
|---|---|---|---|---|---|---|---|
 |
|||||||
| المعرفات | |||||||
| الأسماء المستعارة | P-glycoprotein 1, multidrug resistance protein 1, ATP-binding cassette, sub-family B (MDR/TAP), member 1, ABCB1, P glycoprotein, phospholipid transporter ABCB1, ATP-binding cassette sub-family B member 1, ATP-dependent translocase ABCB1, MDR1, colchicin sensitivity, doxorubicin resistance | ||||||
| معرفات خارجية | |||||||
| نمط التعبير عن الحمض النووي الريبوزي | |||||||
  | |||||||
| المزيد من بيانات التعبير المرجعية | |||||||
| أورثولوج | |||||||
| الأنواع | الإنسان | الفأر | |||||
| أنتريه | n/a | ||||||
| Ensembl | n/a | n/a | |||||
| يونيبروت |
|
| |||||
| RefSeq (مرسال ر.ن.ا.) |
|
| |||||
| RefSeq (بروتين) |
|
| |||||
| الموقع (UCSC | n/a | ||||||
| بحث ببمد | n/a | ||||||
| ويكي بيانات | |||||||
| |||||||
ABCB1 at EBI Gene Expression Atlas | ||
| ABCB1 is differentially expressed in 97 experiments [93 up/106 dn]: 26 organism parts: kidney [2 up/0 dn], bone marrow [0 up/2 dn], ...; 29 disease states: طبيعي [10 up/3 dn], glioblastoma [0 up/2 dn], ...; 30 cell types, 22 cell lines, 11 compound treatments and 16 other conditions. | ||
| Factor Value | Factor | Up/Down |
| Legend: | ||
| طبيعي | حالة المرض | 10/3 |
| لا شيء | علاج مركب | 3/0 |
| خلية سدوية | نوع الخلية | 1/2 |
| الكلية | نوع الخلية | 2/0 |
| MDA-MB-231 | خط الخلية | 0/2 |
| ورم أرومي دبقي متعدد الأشكال | حالة المرض | 0/2 |
| خلية طلائية | نوع الخلية | 0/2 |
| خلية هيلا | خط الخلية | 0/2 |
| أولي | مرحلة المرض | 2/0 |
| نخاع العظم | جزء الكائن | 0/2 |
| ABCB1 expression data in ATLAS | ||
يُعبَّر عن البروتين السكري-P ويتوزع بكثافة في الظهارة المعوية حيث يضخ المواد الغريبة حيويًا (مثل السموم والأدوية) مجددًا إلى داخل لمعة الأمعاء، وفي الخلايا الكبدية حيث يضخها إلى الصفراء، وفي خلايا النبيب القريب للكلية حيث يضخها إلى الرشاحة البولية (في النبيب القريب)، وفي الخلايا البطانية للشعيرات المكوّنة للحاجز الدموي الدماغي والحاجز الدموي الخصوي حيث يضخها مرة أخرى إلى داخل الشعيرات.
البروتين السكري-P هو بروتين سكري يُرمَّز لدى البشر بالمورثة ABCB1.[1] البروتين السكري-P هو ناقل ABC مميز (ينقل ركائز مختلفة عبر الأغشية الداخل خلوية والخارج خلوية) من العائلة الفرعية MDR/TAP. ينقص الإفراز الطبيعي للمواد الغريبة حيويًأ مرة أخرى إلى داخل لمعة الأمعاء بواسطة الحركية الدوائية للبروتين السكري-P كفاءة بعض الأدوية الصيدلانية (والتي يطلق عليها ركائز إن البروتين السكري-P). بالإضافة إلى ذلك، تُعبِّر بعض الخلايا السرطانية أيضًا عن كميات كبيرة من البروتين السكري-P ما يؤدي إلى تضخيم هذا التأثير وجهل هذه السرطانات ذات مقاومة دوائية متعددة. تثبط العديد من الأدوية البروتين السكري-P، ويحدث ذلك بشكل عرضي عادة وليس كآلية عمل رئيسية لها، وكما تفعل ذلك بعض الأغذية. يمكن أن تُدعَى أي مادة مماثلة أحيانًا بمثبط البروتين السكري-P.[2][3]
اكتشِف فيكتور لينغ البروتين السكري-P عام 1971.
المورثة
وجدت مراجعة عام 2015 حول تعدد أشكال ABCB1 أن تأثير تنوع ABCB1 على التعبير عن البروتين السكري-P (RNA المرسال والتعبير البروتيني) و/أو نشاطه في الأنسجة المختلفة (على سبيل المثال، الكبد، والأمعاء، والقلب) قليل على ما يبدو. رغم أن تعدد أشكال ABCB1 وأنماطه الفردانية ارتبطت بالتغيرات في الميل للدواء والاستجابة له، يشمل ذلك أحداثًا وخيمة لركائز ABCB1 المختلفة على أعراق مختلفة، كانت النتائج متضاربة بشكل كبير، وكانت الدلائل في النتائج السريرية محدودة.[4]
البروتين
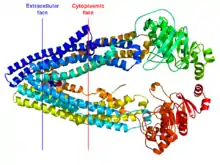
البروتين السكري-P هو بروتين سكري عابر للغشاء وزنه الجزيئي 170 ألف دالتون، منها 10 – 15 ألف دالتون من الغليكوزيل المرتبط بالنهاية N. يحوي النصف الحاوي على النهاية N من الجزيء 6 أطر عابرة للغشاء، متبوعة بإطار سيتوبلازمي كبير وموقع رابط لل ATP يبدي تشابهًا بالحموض الأمينية يزيد عن 65% مع النصف الأول من عديد الببتيد.[5] في 2009، حُلَ لغز البنية الأولى للبروتين السكري-P للثدييات (3G5U).[6] اشتقت البنية من منتج المورثة MDR3 لدى الفئران والذي يُعبَّر عنه بصورة متغايرة لدى خميرة Pichia pastoris. بنية البروتين السكري-P لدى الفئران مشابهه لبنيته في ناقل ABC الجرثومي MsbA (3B5W and 3B5X)[7] والذي يأخذ توجّهًا داخليًا يُعتقَد أنه مهم من أجل ربط الركيزة مع الوريقة الداخلية من الغشاء الخلوي. حُلَّ لغز البنيات الإضافية (3G60 and 3G61) للبروتين السكري-P أيضًا بكشف مواقع رابطة لركيزتين/مثبِطين ببتيديين حلقيين مختلفين. يصطف التجويف غير الشرعي الرابط للبروتين السكري-P مع سلاسل جانبية من الحموض الأمينية الأروماتية (العطرية). من خلال محاكاة الديناميكية الجزيئية، ثبت أن لهذا التسلسل تأثير مباشر على استقرار بنية الناقل (في الأطر الرابطة للنيكليوتيد) ووضع حدود دنيا للتجويف الداخلي الرابطة للدواء.[8]
الأنواع، والنسيج، والتوزع تحت الخلوي
يُعبَّر عن البروتين السكري-P بصورة مبدئية في بعض الأنماط الخلوية في الكبد، والبنكرياس، والكلية، والقولون، والصائم.[9] كما يوجد البروتين السكري-P أيضًا في الخلايا البطانية للأوعية الشعرية في الدماغ.[10]
الوظيفة
تدخل ركائز البروتين السكري-P إما من فتحة في الوريقة الداخلية للغشاء الخلوي أو من فتحة في الجانب السيتوبلازمي من البروتين. يرتبط ATP بالجانب السيتوبلازمي من البروتين. بعد ارتباط كل منهما، ينقل هيدرولاز ATP الركيزة إلى موقع تُفرَز منه إلى خارج الخلية. يحدث تحرر الفوسفات (من جزيء ATP الأصلي) بالتزامن مع إفراز الركيزة. يُحرَّر ADP، ويرتبط جزيء جديد من بالموقع الثانوي الرابط للـATP. يُعاد البروتين إلى وضعه السابق بتأثير الهيدرولاز، ويحرر ADP، وجزيء الفوسفات، حتى تبدأ العملية مرة أخرى.
ينتمي البروتين إلى فوق عائلة نواقل (ABC) كاسيت الرابطة للـ ATP. تنقل بروتينات ABC جزيئات متنوعة عبر الأغشية الخلوية الداخلية والخارجية. تُقسَم مورثات ABC إلى 7 عائلات فرعية متميزة (ABC1, MDR/TAP, MRP, ALD, OABP, GCN20, White). هذا البروتين عضو من العائلة الفرعية MDR/TAP. تُتهَم أغشية العائلة الفرعية MDR/TAP بإحداث المقاومة الدوائية المتعددة.[11]
البروتين السكري-P هو مضخة تدفّق دوائية معتمدة على الـ ATPمن أجل مركبات غريبة حيويًا ذات نوعية عالية للركيزة. يكون مسؤولًا عن نقص تراكم الدواء في الخلايا ذات المقاومة الدوائية المتعددة، وغالبًا ما يتوسط تطور مقاومة للأودية المضادة للسرطان. يعمل هذا البروتين أيضا كناقل في الحاجز الدموي الدماغي. ترتبط الطفرات في هذه المورثة بالمقاومة للكولشيسين والداء المعوي الالتهابي 13. يؤدي الربط البديل واستخدام المعززات البديلة إلى حدوث نسخ متعددة عن المتغيرات.
تتضمن ركائز نواقل البروتين السكري-P عبر الأغشية الخلوية:
- أدوية مثل الكولشيسين، والديسلوراتادلين، والتاكروليموس، والكينيدين.
- أدوية كيمائية مثل مثبطات التوبوإيزوميراز (مثل إيتوبوسايد ودوكسوروبيسين)، والأدوية التي تستهدف النبيبات الدقيقة (مثل الفينبلاستين)، ومثبطات التيروزين كيناز (مثل غيفينتيب وسنتتينيب).
- الليبيدات.
- المواد الغريبة حيويًا.
- الببتيدات.
- البيلروبين.
- الغليكوزيدات القلبية مثل الديجوكسين.
- الأدوية المثبطة للمناعة.
- الهرمونات القشرية السكرية مثل الديكساميتازون.
- الأدوية المضادة لفيروس HIV نمط 1 مثل مثبطات البروتياز، ومثبطات أنزيم النسخ العكسي.
قدرته على نقل الركائز المذكورة في الأعلى تعتبر مسؤولة عن الكثير من الأدوار التي يلعبها البروتين السكري-P، وتتضمن:
تنظيم توزع الأدوية وتوافرها الحيوي
§ قد تؤدي زيادة التعبير المعوي عن البروتين السكري-P إلى نقص امتصاص الأدوية التي تشكّل ركائز للبروتين السكري-P، وبالتالي يحدث زيادة في توافرها الحيوي، دون أن تبلغ تراكيزها البلازمية العلاجية. بالمقابل، قد تحدث تراكيز بلازمية فوق علاجية وسمية دوائية بسبب نقص البروتين السكري-P.
§ يؤدي النقل الخلوي الفعال للأدوية المضادة للأورام إلى حدوث مقاومة دوائية متعددة لهذا الأدوية.
- إزالة المستقلبات السمية والمواد الغريبة حيويًا من الخلايا وطرحها مع البول، والصفراء، وفي لمعة الأمعاء.
- نقل المركبات إلى خارج الدماغ عبر الحاجز الدموي الدماغي.
- منع دخول الإيفراميكتين واللوبيراميد إلى الجهاز العصبي المركزي.
- هجرة الخلايا المتغصنة.
- حماية الخلايا الجذعية المولّدة للدم من السموم.
تثبطه أدوية عديدة مثل الأميودارون، والأزيثرومايسين، والكابتوبريل، والكلاريثرومايسين، والسيكلوسبورين، والبيبرين، والكيرسيتين، والكينيدين، والكينين، والريسبيرين، والريتونافير، والتاريكوادير، والفيراباميل.[12]
مراجع
- Ueda K, Clark DP, Chen CJ, Roninson IB, Gottesman MM, Pastan I (January 1987). "The human multidrug resistance (mdr1) gene. cDNA cloning and transcription initiation". The Journal of Biological Chemistry. 262 (2): 505–8. PMID 3027054. مؤرشف من الأصل في 26 يوليو 2008. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Yu J, Zhou Z, Tay-Sontheimer J, Levy RH, Ragueneau-Majlessi I (September 2017). "Intestinal Drug Interactions Mediated by OATPs: A Systematic Review of Preclinical and Clinical Findings". Journal of Pharmaceutical Sciences. 106 (9): 2312–2325. doi:10.1016/j.xphs.2017.04.004. PMID 28414144. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Dean, Michael (2002-11-01). "The Human ATP-Binding Cassette (ABC) Transporter Superfamily". National Library of Medicine (US), NCBI. مؤرشف من الأصل في 12 فبراير 2006. اطلع عليه بتاريخ 02 مارس 2008. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Wolking S, Schaeffeler E, Lerche H, Schwab M, Nies AT (July 2015). "Impact of Genetic Polymorphisms of ABCB1 (MDR1, P-Glycoprotein) on Drug Disposition and Potential Clinical Implications: Update of the Literature". Clinical Pharmacokinetics. 54 (7): 709–35. doi:10.1007/s40262-015-0267-1. PMID 25860377. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Franck Viguié (1998-03-01). "ABCB1". Atlas of Genetics and Cytogenetics in Oncology and Haematology. مؤرشف من الأصل في 5 يوليو 2019. اطلع عليه بتاريخ 02 مارس 2008. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Aller SG, Yu J, Ward A, Weng Y, Chittaboina S, Zhuo R, Harrell PM, Trinh YT, Zhang Q, Urbatsch IL, Chang G (March 2009). "Structure of P-glycoprotein reveals a molecular basis for poly-specific drug binding". Science. 323 (5922): 1718–22. doi:10.1126/science.1168750. PMC 2720052. PMID 19325113. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Ward A, Reyes CL, Yu J, Roth CB, Chang G (November 2007). "Flexibility in the ABC transporter MsbA: Alternating access with a twist". Proceedings of the National Academy of Sciences of the United States of America. 104 (48): 19005–10. doi:10.1073/pnas.0709388104. PMC 2141898. PMID 18024585. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Ferreira RJ, Ferreira MJ, Dos Santos DJ (June 2012). "Insights on P-Glycoprotein's Efflux Mechanism Obtained by Molecular Dynamics Simulations". Journal of Chemical Theory and Computation. 8 (6): 1853–64. doi:10.1021/ct300083m. PMID 26593820. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Thiebaut F, Tsuruo T, Hamada H, Gottesman MM, Pastan I, Willingham MC (November 1987). "Cellular localization of the multidrug-resistance gene product P-glycoprotein in normal human tissues". Proceedings of the National Academy of Sciences of the United States of America. 84 (21): 7735–8. doi:10.1073/pnas.84.21.7735. PMC 299375. PMID 2444983. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Schinkel AH (April 1999). "P-Glycoprotein, a gatekeeper in the blood-brain barrier". Advanced Drug Delivery Reviews. 36 (2–3): 179–194. doi:10.1016/S0169-409X(98)00085-4. PMID 10837715. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Entrez Gene: ABCB1". مؤرشف من الأصل في 5 ديسمبر 2010. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Drug Development and Drug Interactions: Table of Substrates, Inhibitors and Inducers". مؤرشف من الأصل في 23 أبريل 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة)
- Biochemical pharmacology-7518-2002- صفحات 1-8
- Membrane Transporters: Methods and Protocols by Qing Yan, Humana Press, 2003
- بوابة الكيمياء الحيوية
- بوابة طب
- بوابة علم الأحياء الخلوي والجزيئي
 صور وملفات صوتية من كومنز
صور وملفات صوتية من كومنز
