أكسجين صلب
الأكسجين الصلب هو الحالة الصلبة للأكسجين والتي يمكن الحصول عليها عند الضغط الجوي النظامي عندما تكون درجات الحرارة دون 54.36 كلفن (−218.79 °س). يكون الأكسجين الصلب لون مثل الأكسجين السائل على هيئة مادة شفافة لها لون سماوي.
التحضير
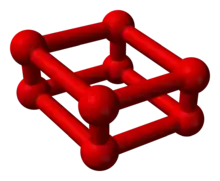
عند تعريض الأكسجين إلى ضغوط مرتفعة تتجاوز 10 غيغا باسكال تتشكّل مادة صلبة حمراء اللون، والتي أظهر تركيبها بادئ الأمر بواسطة تقنيّة مطيافيّة الكتلة أنّها مكوّنة من الأكسجين الرباعي O4 شبه المستقر.[1][2] تبيّن لاحقاً سنة 2006 أنّه عند تعريض الأكسجين لضغوط تصل إلى 20 غيغا باسكال فإنّ المادّة الحمراء المتشكّلة تتكوّن من حلقات من ثماني الأكسجين O8.[3] يكون لهذا التجمّع من الذرّات بنية بلّوريّة حسب النظام البلّوري الثلاثي، ويحتمل أن يكون للمادة خصائص مؤكسدة قويّة أكبر من الأكسجين الثنائي O2 أو الأوزون O3، لذلك فمن المقترح استخدامها من أجل وقود الصواريخ.[1][2]
اكتشف سنة 1990 أنّه عند تعريض الأكسجين الصلب إلى ضغوط تتجاوز 96 غيغا باسكال فإنّه يحصل على طور فلزّي من الأكسجين،[4] كما بيّنت التجارب لاحقاً سنة 1998 أنّ ذلك الطور يصبح ذا موصلية فائقة عند درجات حرارة منخفضة جدّاً.[5]
الخصائص
يعد الأكسجين الصلب O2 الجزيء الوحيد من الجزيئات ثنائية الذرّة التي لديها عزم مغناطيسي.[6] وهذا ما يجعل الأكسجين الصلب محط اهتمام، إذ أنه بعتبر من الأجسام البلورية ذات اللف المغزلي المضبوط spin-controlled،[6] والتي تبدي خصائصاً ذات رتبة مغناطيسية حديدية مضادة عند درجات حرارة منخفضة.
عند ضغوط مرتفعة جداً، يتغير الأكسجين الصلب من حالة المادة العازلة إلى الحالة الفلزية الموصلة،[7] والتي يمكن أن تصبح موصلية فائقة عند درجات حرارة منخفضة جداً.[8]
اقرأ أيضاً
المراجع
- Cacace, Fulvio; de Petris, Giulia; Troiani, Anna (2001). "Experimental Detection of Tetraoxygen". Angewandte Chemie International Edition. 40 (21): 4062–65. doi:10.1002/1521-3773(20011105)40:21<4062::AID-ANIE4062>3.0.CO;2-X. PMID 12404493. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Ball, Phillip (September 16, 2001). "New form of oxygen found". Nature News. مؤرشف من الأصل في 21 أكتوبر 2013. اطلع عليه بتاريخ January 9, 2008. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Lundegaard, Lars F.; Weck, Gunnar; McMahon, Malcolm I.; Desgreniers, Serge; et al. (2006). "Observation of an O8 molecular lattice in the phase of solid oxygen". Nature. 443 (7108): 201–04. Bibcode:2006Natur.443..201L. doi:10.1038/nature05174. PMID 16971946. مؤرشف من الأصل في 27 يونيو 2017. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Desgreniers, S; Vohra, Y. K.; Ruoff, A. L. (1990). "Optical response of very high density solid oxygen to 132 GPa". J. Phys. Chem. 94 (3): 1117–22. doi:10.1021/j100366a020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Shimizu, K.; Suhara, K.; Ikumo, M.; Eremets, M. I.; et al. (1998). "Superconductivity in oxygen". Nature. 393 (6687): 767–69. Bibcode:1998Natur.393..767S. doi:10.1038/31656. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Freiman, Y. A. & Jodl, H. J. (2004). "Solid oxygen". Phys. Rep. 401: 1–228. Bibcode:2004PhR...401....1F. doi:10.1016/j.physrep.2004.06.002. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) -
Desgreniers, S., Vohra, Y. K. & Ruoff, A. L. (1990). "Optical response of very high density solid oxygen to 132 GPa". J. Phys. Chem. 94 (3): 1117–1122. doi:10.1021/j100366a020. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) -
Shimizu, K., Suhara, K., Ikumo, M., Eremets, M. I. & Amaya, K. (1998). "Superconductivity in oxygen". Nature. 393 (6687): 767–769. Bibcode:1998Natur.393..767S. doi:10.1038/31656. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link)
- بوابة الكيمياء
