أسبارتات ناقل الكربامويل
اسبارتاتي ناقل الكربامويل ((بالإنجليزية: Aspartate carbamoyltransferase))اسبارتاتي ناقلة الكربامويل يختصرب( ATCase) يحفز الخطوة الأولى في طريق السكروز بيريميدين شيفرته المختصرة هي(EC 2.1.3.2).وهوانزيم معقد ومتعدد الوحيدات يتكون من 12 مفارز (300 كيلو دالتون في كل مجموعة).[1] وظيفته هي تكوين مفارز هو C6R6، وتشكيل مفارز من 2 أرتب الحفاز (34 كيلو دالتون) و 3 من ديميرس (dimers) مفارز التنظيمية (17 كيلو دالتون). ترتيب خاص للمفارز المحفزة وينظمها في سلوك تفارغي و يعلق ركائز لها.[2]
| اسبارتاتي ناقل الكربامويل | |||||||||
|---|---|---|---|---|---|---|---|---|---|
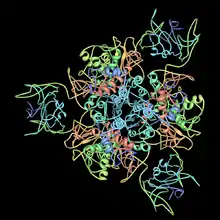 اسبارتاتي ناقل الكربامويل في الإشريكية القولونية. 2ATC PDB. | |||||||||
| أرقام التعريف | |||||||||
| رقم التصنيف الإنزيمي | 2.1.3.2 | ||||||||
| رقم التسجيل CAS | 9012-49-1 | ||||||||
| قواعد البيانات | |||||||||
| قاعدة بيانات الإنزيم | راجع IntEnz | ||||||||
| قاعدة بيانات براونشفايغ | راجع BRENDA | ||||||||
| إكسباسي | راجع NiceZyme | ||||||||
| موسوعة كيوتو | راجع KEGG | ||||||||
| ميتاسيك | المسار الأيضي | ||||||||
| بريام | ملف التعريف | ||||||||
| تركيب بنك بيانات البروتين | RCSB PDB PDBe PDBsum | ||||||||
| الأونتولوجيا الجينية | AmiGO / EGO | ||||||||
| |||||||||
موقعه
اسبارتاتي ناقل الكربامويل لا يتبع ميكايليسالمينتن، ولكنه يقع بين منخفضة النشاط، "بنطاق ضيق" وعالية النشاط، بشكل واسع "استرخاء" .[3] يقوم هذا الانزيم بربط ركائز إلى مفارز المحفزات ويحولها في توازن إلى وحدات صغيرة النتائج التنظيمية .
رد الفعل
اسبارتاتي ناقل الكربامويل هو انزيم ذو درجة عالية من التنظيم يحفز الخطوة الأولى التي تتم في البيريميدين الحيوي، والتكثيف من اسبارتاتي و كرباميل الفوسفات إلى شكل N-كرباميل-L-اسبارتاتي و فوسفات غير عضوي . و يتحكم في معدل الحيوي بيريميدين عن طريق تغيير سرعة الحفاز في الاستجابة إلى مستويات الخلايا في كل من بيريميدين و البيورين . المنتج النهائي للمسار بيريميدين، CTP، يؤدي إلى انخفاض في سرعة الحفاز، في حين أن أدينوسين ثلاثي الفوسفات ( ATP)، والمنتج النهائي للمسار مواز البيورين، يمارس تأثير معاكس، في عملية النشاط التحفيزي.
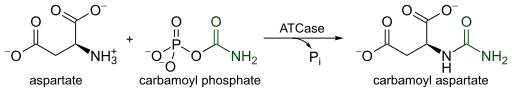
المراجع
- Simmer JP, Kelly RE, Rinker AG Jr, Zimmermann BH, Scully JL, Kim H, Evans DR (1990). "Mammalian dihydroorotase: nucleotide sequence, peptide sequences, and evolution of the dihydroorotase domain of the multifunctional protein CAD". Proceedings of the National Academy of Sciences of the United States of America. 87 (1): 174–8. doi:10.1073/pnas.87.1.174. PMC 53223. PMID 1967494. مؤرشف من الأصل في 03 يونيو 2018. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Macol CP, Tsuruta H, Stec B, Kantrowitz ER (2001). "Direct structural evidence for a concerted allosteric transition in Escherichia coli aspartate transcarbamoylase". Nature Structural Biology. 8 (5): 423–6. doi:10.1038/87582. PMID 11323717. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Helmstaedt K, Krappmann S, Braus GH (2001). "Allosteric regulation of catalytic activity: Escherichia coli aspartate transcarbamoylase versus yeast chorismate mutase". Microbiology and Molecular Biology Reviews : MMBR. 65 (3): 404–21, table of contents. doi:10.1128/MMBR.65.3.404-421.2001. PMC 99034. PMID 11528003. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link)
وصلات اضافية
- Aspartate carbamoyltransferase في المَكتبة الوَطنية الأمريكية للطب نظام فهرسة المواضيع الطبية (MeSH).
قالب:واحد ترانسفيراز الكربون
قالب:استقلاب النوكليوتيدات
قالب:المجمعات متعدد الإنزيمات
- بوابة الكيمياء الحيوية
- بوابة علم الأحياء
- بوابة علم الأحياء الخلوي والجزيئي
 صور وملفات صوتية من كومنز
صور وملفات صوتية من كومنز