نظرية المدارات الجزيئية
نظرية المدارات الجزيئية عبارة عن نظرية تنطلق أساساً من دراسة الخواص الالكترونية للجزيء من وجهة نظر التأثير المتبادل بين ذراته وارتباط هذا التأثير بالمسافة بين الذرات.[1] تعطي فكرة عن توزع الكثافة الإلكترونية و تفسر بعض العلاقات الميكانيكية الكمية للذرة على صورة اعقد هي الجزئ. ففي الجزئ توجد حالات طاقة متفرقة للألكترونات، تتحرك فيها هذه الالكترونات حركة منسقة في المجال الناشئ عنها و عن جميع نوى الجزئ. و بفرضية ان جميع الالكترونات في الجزئ تتوزع على المدارات الموافقة. و يتصف كل مدار بمجموعة خاصة به من الاعداد الكمية التي تعكس خواص الالكترونات في الحالة الطاقية المعنية. وتختلف المدارات في الجزيئات عن المدارات في الذرات بانها متعددة المراكز أي أن الجزيئات تحوي المدارات الذرية.
و تتكون المدارات الجزئية من اتحاد المدارات الذرية أثناء اقترابها من بعضها البعض. و يسمى هذان المداران الجزيئيان بالمدارين الرابط و المفكك أو غير الرابط على التوالي. و الالكترون على المدار الجزيئي الرابط يقضي أكثر وقته بين النوى مساعدا بذلك على ارتباطها كيميائيا، في حين أن الالكترون على المدار الجزيئي المفكك يقضي أكثر وقته خلف النوى مسببا تباعدها و تدافعها عن بعضها البعض. و تعين طبيعة توزع الالكترونات على المدارات الجزئية درجة الرابطة وطاقتها والمسافات بين النوى. و الخواص المغناطيسية للجزيئات و غيرها.
لأن الالكترونات هي المكونات الأساسية للمادة المشاركة في الرابطة، وقد درست مشاركتهم في الربط باستمرار من قبل الكيميائيين. ويجري تقاسم الالكترونات بين الذرات الفردية في الجزيء لتشكيل الروابط الكيميائية التساهمية. عموما، يمكن أن تصل إلى ثلاثة روابط تتشكل بين الذرات في الجزيء.
- رابطة تساهمية واحدة، أو سيغما تنتج عن التفاعل بين نوى ذرات منفصلة (اثنين)
- روابط متعددة ثم يمكن أن ينتج بسبب تكوين الروابط الإضافية بين مدارات تداخل مثل المتماثلات.[2]
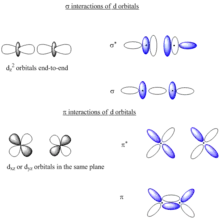
وتقع الإلكترونات في الروابط سيغما Sigma بين الأنوية، في حين يتم إعادة تمركز الإلكترونات في الروابط باي Pi في مناطق أعلى وأسفل النوى.[2]
الاتصال بمخططات «MO» المدار الجزيئي والهندسة الجزيئية
باستخدام نظرية المدار الجزيئي، يمكن رسم المدار الجزيئي والبناء الذي يميز كل فرد من المدارات الذرية الاساسية والمدارات الجزيئية الناتجة عن التفاعلات الذرية لتكوين جزيئات. (S, P, d & f) والمدارات الإلكترونية و الطاقات النسبية، والتفاعلات المدارية المتوقعة من القرب النسبي في طاقات المدارات الذرية الفردية[3]
التطبيقات الكمية
cij
(dz2, dx2-y2, dxz, dyz, dxy)
نظرة عامة
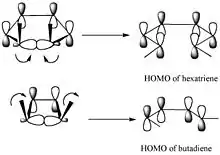
نظرية المدرات الجزيئية (MO) تستخدم لمجموعة من المدارات الذرية الخطية (LCAO) لتمثيل المدارات الجزيئية الناتجة عن الروابط بين الذرات.
انظر أيضا
المراجع
- Daintith, J. (2004). Oxford Dictionary of Chemistry. New York: Oxford University Press. ISBN 0-19-860918-3. الوسيط
|CitationClass=تم تجاهله (مساعدة) - “Sigma and Pi Bonds.” 11/8/13. <http://www.kentchemistry.com/links/bonding/sigmapi.htm>
- Miessler and Tarr (2013), Inorganic Chemistry, 5th ed, 117-165, 475-534.
وصلات خارجية
- Molecular Orbital Theory - Purdue University
- Molecular Orbital Theory - Sparknotes
- Molecular Orbital Theory - Mark Bishop's Chemistry Site
- Introduction to MO Theory - Queen Mary, London University
- Molecular Orbital Theory - a related terms table
- An introduction to Molecular Group Theory - Oxford University
 صور وملفات صوتية من كومنز
صور وملفات صوتية من كومنز
- بوابة الفيزياء
- بوابة الكيمياء
- بوابة كيمياء فيزيائية
- بوابة ميكانيكا الكم