رابطة هالوجينية
الرابطة الهالوجينة (XB) هي رابطة غير تساهمية نتاج تفاعل يحدث بين ذرةالهالوجين (حامض لويس) و قاعدة لويس. و بالرغم من ان الهالوجينات تشارك في أنواع أخرى من الروابط (على سبيل المثال الترابط التساهمي)، وذلك على وجه التحديد الترابط الهالوجيني يحدث عندما يتصرف الهالوجين بوصفه نوع إلكتروفيل .
النشاط الكيميائي :- الهالوجينات نشطة جداً لأنها تفتقد إلى «e» واحد لحالة الاستقرار ويكون بالرابطة التساهمية أو بالرابطة الأيونية . لكي تصل الهالوجينات إلى بنية مستقرة فإنها تسعى لإكمال طبقتها الخارجية وذلك باكتسابها لإلكترون واحد فتعطي أيوناً سالباً . عدد الأكسدة للفلور -1 دائماً وعدد الأكسدة لبقية الهالوجينات أيضاً -1 ما عدا مركبات الأكسجين فإنها تأخذ ما بين +1 إلى +7 لأنها أعلى في السالبية
الترابط
مقارنة بين الهيدروجين والرابطة الهالوجينية:
الرابطة الهيدروجينية: D … H - A
الرابطة الهالوجينية: D … X - A
في كلا الحالتين، D (المانحة) هي ذرة أو مجموعة أو جزيء غنية بالإلكترونات وتمنحها إلى نوع في حالة فقر أو عوز الإلكتروني (H أو X).(H)هي ذرة الهيدروجين المشاركة في HB ، وX هي ذرة الهالوجين المشاركة في XB. A (مستقبل) وهو الذي في حالة فقر الإلكتروني فيسحب الكثافة الإلكترونية من H أو X ، وفقا لذلك. HA و XA، عندما تعتبر كل من الذرات معا، وتسمى الجهات المانحة رابطة الهيدروجين / الهالوجين، وفقا لذلك، وD هي HB / XB المستقبلة. أهم اختلاف بين HB وXB هو ان ذرات الهالوجين هي قواعد لويس، ذرة الهالوجين يمكن على حد سواء التبرع والقبول في رابطة الهالوجين.[1]
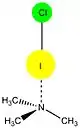
الهالوجينات المشاركة في الرابطة الهالوجنية ما يلي: اليود (I)، البروم (BR)، الكلور (Cl)، وأحيانا الفلور (F). جميع الهالوجينات الأربعة هي قادرة على العمل كجهات مانحة XB (كما ثبت من خلال البيانات النظرية والتجريبية) واتبع الاتجاه العام:
F <Cl <Br <I
.[2]
التاريخ
عام 1863، فريدريك غوثري أعطى التقرير الأول على قدرة ذرات الهالوجين لتشكيل منتجات مانحة للإلكترون جيدة .[3] في هذة التجربة اضاف I2 لمحلول مشبع من نترات الأمونيوم ليعطي NH3I2. عندما عرض المركب للهواء تحلل لل أمونيا واليود التي جعلت قوثري يتحصل على NH3I2.
في عام 1950 روبرت .س . ميوليكين طور نظرية تفصيلية عن المعقدات الواهبة - المستقبلة للالكترونات، وقسمها إلى معقدات خارجية أو داخلية .[4][5][6] المعقدات الخارجية هي التي يكون فيها التجاذب بين الجزئيات الواهبة للإلكترون والمستقبلة للإلكترون، وهي ضعيفة ولها قابلية بسيطة لانتقال الشحنة. المعقدات الداخلية لها نطاق واسع في اعادة توزيع الشحنات . تم استخدام نظرية ميوليكين «Mulliken» لوصف الآلية التي يحدث بها تشكيل XB.
التطبيقات
هندسة البلورات
علم هندسة البلورات: ويركز على طرائق دراسة البلورات هندسياً من حيث شكلها الخارجي، وهو علم ذو ابحاثٍ متنامية ربط بين الحالة الصلبة وكيمياء الجزئيات العليا.[7] هذا المجال الفريد هو متعدد التخصصات إذ أنه يدمج التخصصات التقليدية مثل علم البلورات، الكيمياء العضوية، و الكيمياء غير العضوية, وفي عام 1971 أنشأت شميت أول حقل في إحدى الأصدارات على صورة ثنائيات مقابل تعزيز توجههم نحو الحالة الصلبة.[8] لقد تم تطبيق الربط الهالوجيني في هندسة البلورات، وبحوث المواد، وتكنولوجيا النانو .[9]
ويمكن قياس الزوايا goniometry بين الوجوه وتحديد تناظراتها فراغياً؛ أو من حيث بنية البلورات الداخلية بطريقة رونتغن Rontgen، وفيها يُدرس تحليل البنية الشبكية الفراغية الداخلية للبلورات باستخدام الأشعة السينية x-ray
تحضير متعدد (ثنائي ايودو ثنائي الأسيتيلين)(poly diiododiacetylene)
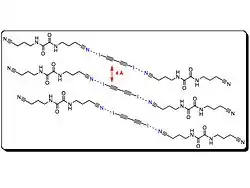
ظهرت تطبيقات استخدام خصائص البوليمرات المقترنة بالعمل الذي قام به «Heeger، McDiaramid»، و شيراكاوا هو القيام باكتشاف البولي اسيتيلين ، وإن كان من الصعب تشغيل هذة المادة. منذ ذلك الحين، تم القيام بعمل لتقليد هذا الأساس. البوليمرات المقترنة (على سبيل المثال، بولي (ف·فينيل enevinylene)). البوليمرات المترافقة لديها العديد من التطبيقات العملية، ويتم استخدامها في عدة أجهزة مثل :الخلية الضوئية و صمام ثنائي عضوي باعث ضوء و حقل تأثير الترانزستور ثانية، و استشعار كيميائي. «Goroff» وآخرون.

البنيات المسامية

الترابط الهالوجيني في الجزيئات البيولوجية
لبعض الوقت، تم تجاهل أهمية الرابطة الهالوجينية في الشكل البنائي للجزيئات البيولوجية. على أساس بلورة واحدة في معقدات معلومات بنك البروتين (PDB) (يوليو 2004 نسخة)

المراجع
- Metrangolo, P.; Resnati, G. (2001), "Halogen Bonding: A Paradigm in Supramolecular Chemistry", Chem. Eur. J, 7, صفحات 2511–2519, doi:10.1002/1521-3765(20010618)7:12<2511::AID-CHEM25110>3.0.CO;2-T الوسيط
|CitationClass=تم تجاهله (مساعدة); الوسيط|separator=تم تجاهله (مساعدة)CS1 maint: ref=harv (link) - Politzer, P.; Lane, P; Concha, MC; Ma, Y; Murray, JS; et al. (2007), "An Overview of Halogen Bonding", J. Mol. Model, 13, صفحات 305–311, doi:10.1007/s00894-006-0154-7, PMID 17013631 الوسيط
|CitationClass=تم تجاهله (مساعدة); الوسيط|separator=تم تجاهله (مساعدة); Explicit use of et al. in:|الأول=(مساعدة)CS1 maint: ref=harv (link) - Guthrie, F. (1863), "Xxviii.—On the Iodide of Iodammonium", J. Chem. Soc, 16, صفحات 239–244, doi:10.1039/js8631600239 الوسيط
|CitationClass=تم تجاهله (مساعدة); الوسيط|separator=تم تجاهله (مساعدة)CS1 maint: ref=harv (link) - Mulliken, R.S. (1950), J. Am. Chem. Soc, 72, صفحة 600, doi:10.1021/ja01157a151 الوسيط
|CitationClass=تم تجاهله (مساعدة); الوسيط|separator=تم تجاهله (مساعدة); مفقود أو فارغ|title=(مساعدة)CS1 maint: ref=harv (link) - Mulliken, R.S. (1952), J. Am. Chem. Soc, 74, صفحات 811–824, doi:10.1021/ja01123a067 الوسيط
|CitationClass=تم تجاهله (مساعدة); الوسيط|separator=تم تجاهله (مساعدة); مفقود أو فارغ|title=(مساعدة)CS1 maint: ref=harv (link) - Mulliken, R.S. (1952), J. Phys. Chem. Soc, 56, صفحات 801–822, doi:10.1021/j150499a001 الوسيط
|CitationClass=تم تجاهله (مساعدة); الوسيط|separator=تم تجاهله (مساعدة); مفقود أو فارغ|title=(مساعدة)CS1 maint: ref=harv (link) - Braga, D.; Desiraju, Gautam R.; Miller, Joel S.; Orpen, A. Guy; Price, Sarah (Sally) L.; et al. (2002), "Innovation in Crystal Engineering", CrystEngComm, 4, صفحات 500–509, doi:10.1039/b207466b الوسيط
|CitationClass=تم تجاهله (مساعدة); الوسيط|separator=تم تجاهله (مساعدة); Explicit use of et al. in:|الأول=(مساعدة)CS1 maint: ref=harv (link) - Schmidt, G.M.J. (1971), "Photodimerization in the solid state", Pure Appl. Chem, 27, صفحات 647–678, doi:10.1351/pac197127040647 الوسيط
|CitationClass=تم تجاهله (مساعدة); الوسيط|separator=تم تجاهله (مساعدة)CS1 maint: ref=harv (link) - Metrangolo, P.; Resnati, Giuseppe; Pilati, Tullio; Liantonio, Rosalba; Meyer, Franck; et al. (2007), "Engineering Functional Materials by Halogen Bonding", J. Polym. Sci. Part A: Polym. Chem, 45, صفحات 1–14, Bibcode:2007JPoSA..45....1M, doi:10.1002/pola.21725 الوسيط
|CitationClass=تم تجاهله (مساعدة); الوسيط|separator=تم تجاهله (مساعدة); Explicit use of et al. in:|الأول=(مساعدة)CS1 maint: ref=harv (link) - Howard, E.I.; Sanishvili, R; Cachau, RE; Mitschler, A; Chevrier, B; Barth, P; Lamour, V; Van Zandt, M; Sibley, E (2004), "Ultrahigh resolution drug design I: Details of interactions in human aldose reductase-inhibitor complex at 0.66 Å", Proteins : Structure, Function, and Bioinformatics, 55, صفحات 792–804, doi:10.1002/prot.20015, PMID 15146478 الوسيط
|CitationClass=تم تجاهله (مساعدة); الوسيط|separator=تم تجاهله (مساعدة)CS1 maint: ref=harv (link)
- بوابة الكيمياء