تسلسل البروتين
تسلسل البروتين هو عملية لتحديد تسلسل الحمض الأميني لكل أو جزء من البروتين أو الببتيد.[1] وقد يساعد ذلك على تحديد البروتين أو توصيف تعديلاته بعد الترجمة. عادة، يوفر التسلسل الجزئي للبروتين معلومات كافية (علامة تسلسلية واحدة أو أكثر) لتحديدها بالرجوع إلى قواعد بيانات متواليات البروتين المشتقة من الترجمة النظرية للجينات.
طريقتان مباشرتان رئيسيتان لتسلسل البروتين هما قياس الطيف الكتلي وتدهور إدمان باستخدام مرمز بروتين (Sequencer). تعد طرق قياس الطيف الكتلي هي الأكثر استخدامًا على نطاق واسع في تحديد تسلسل البروتين وتحديده، لكن تدهور إدمان يبقى أداة قيّمة لتحديد خصائص N-terminus .
تحديد تكوين الأحماض الأمينية
غالبا ما يكون من المرغوب فيه معرفة تركيبة الأحماض الأمينية غير المرتبة للبروتين قبل محاولة العثور على التسلسل المرتب، حيث يمكن استخدام هذه المعرفة لتسهيل اكتشاف الأخطاء في عملية التسلسل أو للتمييز بين النتائج الغامضة. ويمكن أيضا معرفة تواتر بعض الأحماض الأمينية المستخدمة لاختيار أي البروتياز لاستخدامها في عملية الهضم من البروتين. ويمكن أيضا أن يكون سوء التفسير من انخفاض مستويات الأحماض الأمينية غير القياسية (على سبيل المثال نوريلوسين) في البروتينات التي يتم تحديدها.
[1] الطريقة العامة التي يشار إليها غالباً باسم تحليل الأحماض الأمينية [2] لتحديد تردد الحمض الأميني هي كما يلي:
- تحليل المائي لكمية معروفة من البروتين في الأحماض الأمينية المكونة لها.
- فصل وتحديد كمية الأحماض الأمينية في بعض الطريق.
التحلل المائي
تتم عملية التحلل المائي عن طريق تسخين عينة من البروتين في حمض الهيدروكلوريك M 6 إلى 100-110 درجة مئوية لمدة 24 ساعة أو أكثر. قد تتطلب البروتينات التي تحتوي على العديد من مجموعات الهيدروفوبية الضخمة فترات تسخين أطول. ومع ذلك، فإن هذه الظروف قوية للغاية لدرجة أن بعض الأحماض الأمينية (سيرين، ثريونين، تيروزين، تريبتوفان، جلوتامين، وسيستين) متدهورة. للتحايل على هذه المشكلة، يقترح Biochemistry Online تسخين عينات منفصلة لأوقات مختلفة، وتحليل كل حل ناتج، واستقراء إلى وقت عدم التحلل. يقترح راستول مجموعة متنوعة من الكواشف لمنع أو الحد من التدهور، مثل الكواشف ثيول أو الفينول لحماية التربتوفان والتيروزين من هجوم الكلور، وقبل السيستين. كما يقترح أيضًا قياس كمية الأمونيا المتطورة لتحديد مدى تحلل الأميد.
الفصل والكميه
يمكن فصل الأحماض الأمينية عن طريق كروماتوغرافيا التبادل الأيوني ثم اشتقاقها لتسهيل اكتشافها. أكثر شيوعا، يتم اشتقاق الأحماض الأمينية ثم حلها عن طريق مرحلة عكسية HPLC.
يتم إعطاء مثال على اللوني التبادل الأيوني من قبل NTRC باستخدام polycyated polystyrene كمصفوفة، مضيفا الأحماض الأمينية في المحاليل الحمضية ويمر حاجز من زيادة درجة الحموضة بشكل مطرد من خلال العمود. تتم إزالة الأحماض الأمينية عندما يصل الرقم الهيدروجيني إلى نقاط كهروضوئية كل منها. بمجرد فصل الأحماض الأمينية، يتم تحديد الكميات الخاصة بها بإضافة كاشف سيشكل مشتقًا ملونًا. إذا كانت كميات الأحماض الأمينية تزيد على 10 نانومول، يمكن استخدام النينهيدرين لذلك ؛ يعطي لونًا أصفرًا عندما يتفاعل مع البرولين، والأرجواني الزهري مع الأحماض الأمينية الأخرى. تركيز الأحماض الأمينية يتناسب مع امتصاص المحلول الناتج. مع كميات صغيرة جدا، وصولا إلى 10 pmol ، يمكن تشكيل مشتقات الفلورسنت باستخدام الكواشف مثل (OPA)أو fluorescamine.
قد يستخدم اشتقاق العمود قبل استخدام كاشف Edman لإنتاج مشتق تم اكتشافه بواسطة ضوء UV. تتحقق حساسية أكبر باستخدام كاشف يولد مشتق الفلورسنت. تخضع الأحماض الأمينية المشتقة لكروماتوجراف طور معكوس، وعادة ما تستخدم عمود سيليكا C8 أو C18 وتدرج شطف محسن. يتم الكشف عن الأحماض الأمينية المستحدثة باستخدام كاشف للأشعة فوق البنفسجية أو الفلورية ومناطق الذروة بالمقارنة مع تلك الخاصة بالمعايير المشتقة من أجل تحديد كل حمض أميني في العينة.
تحليل الحمض الاميني N-terminal
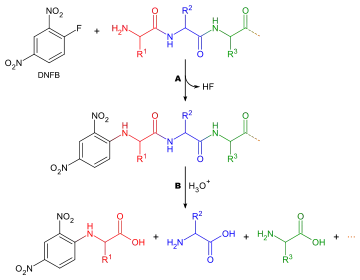
إن تحديد أي الأحماض الأمينية تشكل terminal-N لسلسلة الببتيد مهمه لسببين:للمساعدة في ترتيب تسلسل شظايا الببتيد الفردية في سلسلة كاملة، ولأن الجولة الأولى من تدهور Edman غالباً ما تكون ملوثة بالشوائب، وبالتالي لا تعطي تحديد دقيق للحمض الأميني N- terminal. فيما يلي طريقة معممة لتحليل الأحماض الأمينية في N-terminal:
- رد الببتيد مع الكاشف الذي سوف يحدد بشكل انتقائي الحمض الأميني الطرفي.
- تحلل البروتين.
- تحديد الحمض الأميني عن طريق اللوني والمقارنة مع المعايير.
هناك العديد من الكواشف المختلفة التي يمكن استخدامها لتسمية الأحماض الأمينية الطرفية. تتفاعل جميعها مع مجموعات الأمين وبالتالي ترتبط أيضًا بمجموعات الأمين في السلاسل الجانبية للأحماض الأمينية مثل الليسين - ولهذا السبب من الضروري توخي الحذر في تفسير اللونيات لضمان اختيار المكان الصحيح. اثنان من الكواشف الأكثر شيوعًا هما كاشف سانجر (1 فلورو -2,4 - دينترو بنزين) ومشتقات دانسيلي مثل كلوريد دانسيلي. ويمكن استخدام Phenylisothiocyanate ، كاشف لتدهور إدمان. تنطبق الأسئلة نفسها هنا كما في تحديد تركيبة الأحماض الأمينية، باستثناء أنه لا توجد حاجة إلى البقع، حيث تنتج المواد الكاشفة مشتقات ملونة ولا يتطلب سوى التحليل النوعي. لذلك ليس من الضروري أن تتم إزالة الحمض الأميني من عمود اللوني، مقارنة فقط بالمعيار. هناك اعتبار آخر يأخذ بعين الاعتبار أنه بما أن أي مجموعات أمينية سوف تتفاعل مع كاشف الوسم، فلا يمكن استخدام اللوني التبادلي التبادلي، ويجب استخدام كروماتوجراف طبقة رقيقة أو كروماتوغرافي سائل عالي الضغط بدلاً من ذلك.
تحليل الحمض الأميني C-terminal
عدد الطرق المتاحة لتحليل الأحماض الأمينية نهاية كربوكسيلية أقل بكثير من عدد الطرق المتاحة لتحليل N-terminal. الطريقة الأكثر شيوعا هي إضافة carboxypeptidaseإلى محلول من البروتين، وأخذ عينات على فترات منتظمة، وتحديد الحمض الأميني محطة من خلال تحليل مؤامرة من تركيزات الأحماض الأمينية مع الزمن. ستكون هذه الطريقة مفيدة جدًا في حالة polypeptides و N termini المحظور البروتين. سيساعد التتابعات الطرفية C بشكل كبير في التحقق من التراكيب الأولية للبروتينات المتنبأ بها من تسلسلات الدنا، وكشف أي معالجة ما بعد الترجمة لمنتوجات الجينات من تسلسلات codon المعروفة.
تدهور Edman
إن تدهور Edman هو رد فعل مهم جداً لتسلسل البروتين، لأنه يسمح بتكوين تركيبة الأحماض الأمينية المطلوبة للبروتين. تنتشر أجهزةEdman المتسلسلة التلقائية الآن على نطاق واسع، وهي قادرة على تسلسل الببتيدات لتصل إلى ما يقرب من 50 من الأحماض الأمينية الطويلة. يتبع مخطط تفاعل لتسلسل البروتين بواسطة تدهور إدمان. يتم وضع بعض الخطوات في وقت لاحق.
- كسر أي جسور ثاني كبريتيد في البروتين مع عامل اختزال مثل 2-mercaptoethanol. قد تكون مجموعة الحماية مثل حمض اليوداكتيك ضروريًا لمنع الروابط من إعادة التشكيل.
- فصل وتطهير السلاسل الفردية من مجمع البروتين، إذا كان هناك أكثر من واحد.
- تحدد تركيبة الأحماض الأمينية لكل سلسلة.
- تحديد الأحماض الأمينية الطرفية لكل سلسلة.
- كسر كل سلسلة في شظايا تحت 50 من الأحماض الأمينية طويلة.
- فصل وتنقية الأجزاء.
- تحديد تسلسل كل جزء.
- تكرار مع نمط مختلف من الانقسام.
- بناء تسلسل البروتين الكلي
الهضم في شظايا الببتيد
الببتيدات أطول من حوالي 50-70 من الأحماض الأمينية الطويلة لا يمكن أن تكون متسلسلة بشكل موثوق به بواسطة تدهور إدمان. وبسبب هذا، يجب تقسيم سلاسل البروتين الطويلة إلى شظايا صغيرة يمكن بعد ذلك تسلسلها بشكل فردي. يتم إجراء الهضم إما عن طريق endopeptidases مثل التربسين أو البيبسين أو بواسطة الكواشف الكيميائية مثل بروميد السيانوجين. تعطي الإنزيمات المختلفة أنماط انقسام مختلفة، ويمكن استخدام التراكب بين الشظايا لبناء تسلسل شامل.
التفاعل
يتم كثف الببتيد المتسلسل على سطح صلب. أحد الركائز المشتركة هي الألياف الزجاجية المطلية بـ polybrene ، وهو بوليمر كاتيوني. تمت إضافة كاشف Edman ، phenylisothiocyanate (PITC) ، إلى الببتيد الممتز، إلى جانب محلول عازل أساسي أقل ما يقال من 12٪ تريميثيل أمين. هذا يتفاعل مع مجموعة الأمين من الأحماض الأمينيه N-terminal.
يمكن بعد ذلك فصل الحمض الأميني الطرفي بشكل انتقائي عن طريق إضافة حمض لا مائي. المشتقة ثم الايزوميرات لإعطاء بديل phenylthiohydantoin ، والتي يمكن غسلها وتحديدها بواسطة اللوني، ويمكن تكرار الدورة. تبلغ كفاءة كل خطوة حوالي 98٪، مما يسمح بتحديد 50 حمضًا أمينيًا بشكل موثوق به.

بروتين الترميز
بروتين [3] هو جهاز يقوم بتحليل إدمان بطريقة آلية. يتم تثبيت عينة من البروتين أو الببتيد في وعاء التفاعل لبروتين الترانزستور، ويتم إجراء تدهور إدمان. كل دورة تطلق وتستمد من حمض أميني واحد من البروتين N-terminus أو الببتيد N-terminus ، ومن ثم يتم التعرف على مشتق الأحماض الأمينية الذي تم إصداره بواسطة HPLC. تتم عملية التسلسل بشكل متكرر لعديد الببتيدات بالكامل حتى يتم إنشاء كامل التسلسل القابل للقياس أو لعدد محدد مسبقًا من الدورات.
تحديد بواسطة مطياف الكتلة
تحديد هوية البروتين هو عملية تحديد اسم لبروتين من الفائدة (POI) ، بناءً على تسلسل الحمض الأميني. عادة، يحتاج فقط جزء من تسلسل البروتين إلى أن يتم تحديده تجريبيا من أجل التعرف على البروتين مع الإشارة إلى قواعد بيانات تسلسلات البروتين التي تم استخلاصها من تسلسلات DNA من جيناتها. قد تشمل توصيف البروتين الإضافي وتأكيد المصطلحين C terminal وN للنقطة المهمة، وتحديد المتغيرات المتسلسلة وتحديد أي تعديلات ما بعد الترجمة موجودة.
بروتينات هضمية
تم وصف مخطط عام لتحديد البروتين
- يتم عزل POI ، عادةً بواسطة إس دي إس بايج أو كروماتوغرافي.
- قد يتم تعديل POI المعزول كيميائياً لتثبيت بقايا السيستين (على سبيل المثال S-amidomethylation أو S-carboxymethylation).
- يتم هضم POI مع بروتياز معين لتوليد الببتيدات. التربسين ، الذي يشق انتقائيًا على الجانب C-terminal من مخلفات Lysine أو Arginine ، هو الأنزيم الأكثر استخدامًا. وتشمل مزاياه i) تواتر مخلفات Lys و Arg في البروتينات، ii) خصوصية عالية من الإنزيم، iii) استقرار الإنزيم و iv) مدى ملاءمة الببتيدات التريبتية لقياس الطيف الكتلي.
- قد تكون peptides desalted لإزالة الملوثات المتأينة وتعرض ل MALDI-TOF مطياف الكتلة. قد يوفر القياس المباشر لكتل الببتيدات معلومات كافية لتحديد البروتين (انظر بصمة كتلة الببتيد ولكن غالباً ما يتم استخدام تجزئة الببتيدات داخل مطياف الكتلة للحصول على معلومات حول تتابعات الببتيدات. بدلا من ذلك، قد يتم تحلية الببتيدات وفصلها بواسطة مرحلة عكسية HPLC ويتم إدخالها إلى مطياف الكتلة عبر مصدر تأين بالترذيذ الإلكتروني. قد توفر LC-ESI-MS معلومات أكثر من MALDI-MS للتعرف على البروتين ولكنها تستخدم المزيد من الوقت للأجهزة.
- اعتمادًا على نوع مطياف الكتلة، قد يحدث تجزئة أيونات الببتيد عبر مجموعة متنوعة من الآليات مثل الانحلال بفعل التصادم (CID) أو Post-source day ( PSD). في كل حالة، يوفر نمط أيونات الشظايا من الببتيد معلومات حول تسلسلها.
- ثم يتم مطابقة المعلومات بما في ذلك الكتلة المقاسة من أيونات الببتيد المفترضة وأيونات أيونات الشظايا مقابل قيم الكتلة المحسوبة من التحليل البروتوجرافي (في السيليكو) المفاهيمي وتجزئة قواعد البيانات لتسلسل البروتين. سيتم العثور على تطابق ناجح إذا تجاوزت درجته حدًا استنادًا إلى معلمات التحليل. وحتى إذا لم يكن البروتين الفعلي ممثلاً في قاعدة البيانات، فإن المطابقة للخطأ تسمح بالتعريف المفترض للبروتين على أساس تشابه البروتينات المثالية. تتوفر مجموعة متنوعة من حزم البرامج لإجراء هذا التحليل.
- تقوم حزم البرامج عادةً بإنشاء تقرير يوضح هوية (رمز الدخول) لكل بروتين محدد، ودرجة تطابقها، وتوفر مقياسًا للقوة النسبية للمطابقة التي يتم فيها تحديد عدة بروتينات.
- يستخدم الرسم البياني للببتيدات المتطابقة على تسلسل البروتين المحدد لإظهار التغطية التسلسلية (٪ من البروتين المكتشفة بالببتيدات). حيث يعتقد أن POI أصغر بكثير من البروتين المتطابق، قد يشير الرسم البياني إلى ما إذا كانت POI عبارة عن جزء N-or C-terminal من البروتين المحدد
تسلسل دي نوفو De novo
إن نمط تجزئة الببتيد يسمح بالتعريف المباشر لتسلسله بواسطة [تسلسل دي نوفو ببتيد | تسلسل دي نوفو]. ويمكن استخدام هذا التسلسل لمطابقة قواعد بيانات تسلسلات البروتين أو التحقيق في بعد متعدية التعابير أو تعديلات كيميائية. قد يقدم دليلاً إضافياً على توصيف البروتين الذي تم إجراؤه على النحو الوارد أعلاه.
N- و C-termini
لا تتضمن الببتيدات المتطابقة أثناء تحديد البروتين بالضرورة N- أو C-termini المتوقع للبروتين المتطابق. قد ينتج هذا عن الببتيدات N- أو C- الطرفية التي يصعب تحديدها بواسطة MS (على سبيل المثال إما أن تكون قصيرة جدًا أو طويلة جدًا) ، أو يتم تعديلها بعد الترجمة (على سبيل المثال، acetylation N-terminal) أو اختلافًا حقيقيًا عن التوقع. يمكن تحديد التعديلات بعد الترجمة أو termini المقتطعة عن طريق فحص أكثر دقة للبيانات (أي تسلسل "de novo"). قد يكون من المفيد أيضًا استخدام الخلاصة المتكررة باستخدام بروتياز ذات خصوصية مختلفة
تعديلات ما بعد الترجمة
في حين يمكن استخدام المقارنة التفصيلية لبيانات MS مع التنبؤات المستندة إلى تسلسل البروتين المعروف لتحديد التعديلات بعد متعدية، كما يمكن استخدام المناهج المستهدفة للحصول على البيانات. على سبيل المثال، قد يساعد التخصيب النوعي ل phosphopeptides في تحديد مواقع فسفرة في البروتين. يمكن للطرق البديلة لتجزئة الببتيد في مطياف الكتلة، مثل ETD أو ECD ، إعطاء معلومات تسلسل تكميلية.
تقرير الكتلة الكاملة
الكتلة الكاملة للبروتين هي مجموع كتل بقايا الأحماض الأمينية بالإضافة إلى كتلة جزيء الماء ويتم ضبطها لأي تعديلات ما بعد الترجمة. على الرغم من أن البروتينات المؤينة أقل جودة من الببتيدات المشتقة منها، يمكن أن يكون البروتين الموجود في المحلول قابلاً للتعرض لـ ESI-MS وكتلته تقاس بدقة 1 جزء في 20000 أو أفضل. وكثيراً ما يكون ذلك كافياً للتأكيد على termini (وبالتالي أن تطابقات الكتلة المقاسة بالبروتين التي تنبأت من تسلسلها) وتستنتج وجود أو عدم وجود العديد من التعديلات بعد متعدية.
الحدود والقيود
لا ينتج التحلل البروتيني دائمًا مجموعة من الببتيدات القابلة للتحليل بسهولة والتي تغطي كامل تسلسل POI. لا يؤدي تشظّي الببتيدات في مطياف الكتلة إلى أيونات تناظر الانقسام في كل رابطة ببتيدية. وهكذا، فإن التتابع المستنتج لكل ببتيد ليس بالضرورة مكتملًا. لا تفرق الطرق القياسية للتجزئة بين بقايا الليوسين والـ Isoleucine لأنها متساوية.
نظرًا لأن تدهور إدمان يحدث من المحطة N للبروتين، فإنه لن يعمل إذا تم تعديل N- terminus كيميائيًا (على سبيل المثال بواسطة acetylation أو تشكيل حمض Pyroglutamic). تدهور إدمان عموما ليست مفيدة لتحديد مواقف جسور ثاني كبريتيد. كما يتطلب كميات peptide من 1 picomole أو أعلى للحصول على نتائج ملحوظة، مما يجعلها أقل حساسية من mass spectrometry
التنبؤ من تسلسل الحمض النووي / الحمض النووي الريبي
في علم الأحياء، يتم إنتاج البروتينات بواسطة ترجمة من الرنا المرسال (mRNA) مع تسلسل البروتين المستمد من تسلسل الكودونات في mRNA. يتم تكوين الحمض النووي الريبوزي نفسه من قبل النسخ [] من الجينات ويمكن تعديله. هذه العمليات مفهومة بما فيه الكفاية لاستخدام خوارزميات الكمبيوتر لأتمتة توقعات تسلسلات البروتين من تسلسلات الحمض النووي، مثل من مشاريع تسلسل الحمض النووي الجينوم الكامل، وأدت إلى توليد قواعد بيانات كبيرة من متواليات البروتين مثل يونيبروت. تعتبر متواليات البروتين المتنبأ بها موردًا مهمًا للتعرف على البروتين عن طريق قياس الطيف الكتلي.
من الناحية التاريخية، تم ترجمة متواليات قصيرة من البروتين (10 إلى 15 وحدة بنائية) تم تحديدها بواسطة تدهور إدمان إلى متواليات الدنا التي يمكن استخدامها كمسابير أو بادئات لعزل استنساخ جزيئي من الجينة أو الحمض النووي المكمل. ثم تم تحديد تسلسل الحمض النووي المستنسخة واستخدامها لاستنتاج تسلسل الحمض الأميني الكامل للبروتين.
أدوات المعلوماتية الحيوية
توجد أدوات [Bioinformatics] للمساعدة في تفسير الأطياف الكتلية (انظر تسلسل الببتيد دي نوفو ، لمقارنة أو تحليل تسلسلات البروتين (انظر تحليل التسلسل ، أو البحث في قواعد البيانات باستخدام تتابعات الببتيد أو البروتين. (انظر بلاست)
انظر أيضا
- البروتيوميات
- تسلسل الحمض النووي
المراجع
- "معلومات عن تسلسل البروتين على موقع meshb.nlm.nih.gov". meshb.nlm.nih.gov. مؤرشف من الأصل في 22 نوفمبر 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة)
- بوابة الكيمياء الحيوية