إيميدازوليدين
إيميدازوليدين هو مركب عضوي حلقي غير متجانس له الصيغة الكيميائية C3H8N2.
| إيميدازوليدين | |
|---|---|
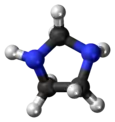 Ball-and-stick model of imidazolidine |
 Structural formula of imidazolidine |
| التسمية المفضلة للاتحاد الدولي للكيمياء البحتة والتطبيقية | |
Imidazolidine | |
| المعرفات | |
| رقم CAS | 504-74-5 |
| بوب كيم (PubChem) | 449488 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| الخواص | |
| الصيغة الجزيئية | C3H8N2 |
| الكتلة المولية | 72.11 غ/مول |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
ينتمي المركب إلى مجموعة مركبات أمينال؛ وهو يتألف بنيوياً من حلقة خماسية مشبعة حاوية على ذرتي نتروجين، وهو بذلك يعد الشكل المشبع من إيميدازول.
التحضير
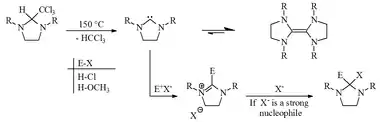
يحضر المركب ومشتقاته من تفاعل تكاثف بين مركبات 2,1-ثنائي أمين مع الألدهيدات؛ حيث تكون عادة واحدة أو كلتا ذرتي النتروجين مستبدلة بمجموعة ألكيل أو بنزيل.[3]
حضر مركب إيميدازوليدين غير المستبدل لأول مرة سنة 1952.[4]
الخواص والتفاعلات
لا يعد مركب إيميدازوليدين غير المستبدل من المركبات المستقرة، إذ يميل إلى التفاعل ليتحول إلى شكل أكثر استقراراً؛[5] إذ أن الحلقة غالباً ما تكون عرضة إلى تفاعل حلمهة ليتشكل ثنائي الأمين والألدهيد الموافق.[3]
يعطي تفاعل نزع الهيدروجين من الكربون رقم 2 جذر كيميائي كربيني يدعى ثنائي هيدرو إيميدازول-2-يليدين Dihydroimidazol-2-ylidene؛ حيث تشكل مشتقات الأخير العديد من مركبات الكربين المستديمة المقاومة للتفكك؛[6] والتي كان الكيميائي هانز-فيرنر فانتسليك Hans-Werner Wanzlick قد نشر عنها في ستينات القرن العشرين.[7][8][9]
المراجع
- معرف بوب كيم: https://pubchem.ncbi.nlm.nih.gov/compound/449488 — تاريخ الاطلاع: 6 أكتوبر 2016 — العنوان : Imidazolidine — الرخصة: محتوى حر
- معرف بوب كيم: https://pubchem.ncbi.nlm.nih.gov/compound/449488
- Ferm, R. J.; Riebsomer, J. L. From "The chemistry of the 2-imidazolines and imidazolidines" Chemical Reviews, 1954, 54, 593-613. doi:10.1021/cr60170a002
- E. D. Bergmann; E. Meeron; Y. Hirshberg; S. Pinchas (1952). "Reaction products of primary β-hydroxy-amines with carbonyl compounds. IV. Infrared and ultraviolet absorption spectra of ethylenediamine derivatives". Rec. Trav. Chim. 71 (2): 200–212. doi:10.1002/recl.19520710211. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Madeleine M. Joullie; George M. J. Slusarczuk; Adrienne S. Dey; Paul B. Venuto; Ronald H. Yocum (1967). "Synthesis and properties of fluorine-containing heterocyclic compounds. IV. N,N-Unsubstituted imidazolidine". J. Org. Chem. 32 (12): 4103–4105. doi:10.1021/jo01287a100. الوسيط
|CitationClass=تم تجاهله (مساعدة) - A. J. Arduengo; H. V. R. Dias; R. L. Harlow; M. Kline (1992). "Electronic stabilization of nucleophilic carbenes". J. Am. Chem. Soc. 114 (14): 5530. doi:10.1021/ja00040a007. الوسيط
|CitationClass=تم تجاهله (مساعدة) - H.-W. Wanzlick and E. Schikora (1960). "Ein neuer Zugang zur Carben-Chemie". Angewandte Chemie. 72 (14): 494. doi:10.1002/ange.19600721409. الوسيط
|CitationClass=تم تجاهله (مساعدة) -
H.-W. Wanzlick and E. Schikora (1960). "Ein nucleophiles Carben". Chemische Berichte. 94 (9): 2389–2393. doi:10.1002/cber.19610940905. الوسيط
|CitationClass=تم تجاهله (مساعدة) -
H.-W. Wanzlick (1962). "Aspects of Nucleophilic Carbene Chemistry". Angew. Chem. Int. Ed. Engl. 1 (2): 75. doi:10.1002/anie.196200751. الوسيط
|CitationClass=تم تجاهله (مساعدة)
- بوابة الكيمياء