أحادي كلورامين
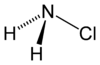
أحادي كلورامين (كما يعرف باسم كلورامين فقط) هو مركب كيميائي من النتروجين والكلور والهيدروجين له الصيغة NH2Cl،[3] ويكون على شكل غاز عديم اللون.
| أحادي كلورامين | |
|---|---|
 أحادي كلورامين | |
 أحادي كلورامين | |
| المعرفات | |
| رقم CAS | 10599-90-3 |
| بوب كيم (PubChem) | 25423 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| الخواص | |
| الصيغة الجزيئية | NH2Cl |
| الكتلة المولية | 51.48 غ/مول |
| المظهر | غاز عديم اللون |
| نقطة الانصهار | −66 °س |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
التحضير
يحضر أحادي كلورامين من تفاعل الأمونياك (أو مشتقاته) مع حمض تحت الكلوروز،[4] وذلك ضمن شروط قلوية خفيفة:
كما يمكن التحضير من تفاعل الكلور المباشر مع الأمونياك:[5]
الخصائص
في الحالة النقية فإن مركب أحادي كلورامين غير مستقر ويتفكك في الشروط في العادية:
لذلك من أجل الاستخدام يكون في الغالب على شكل محلول مائي. بالمقابل، فإنه يكون مستقراً عند الضغوط المنخفضة وفي المحاليل الممدة.[6]
الاستخدامات
يستخدم أحادي كلورامين على شكل مطهر لاستخدامات مختلفة منها تعقيم المياه لكونه أخف درجة من الكلور الأكال[؟]، وأكثر ثباتية تجاه أشعة الضوء من مركبات تحت الكلوريت.[7] يقوم أحادي كلورامين بأكسدة مركبات السلفهيدريل وثنائي الكبريتيد بتفس الأسلوب الذي يقوم به حمض تحت الكلور HClO،[8] مع العلم أن NH2Cl لديه فقط 0.4% من السمية الحيوية الموجودة لدى HClO.[9]
يعد أحادي كلورامين أحد المركبات الوسطية المهمة أثناء تحضير الهيدرازين.
طالع أيضاً
المراجع
- معرف بوب كيم: https://pubchem.ncbi.nlm.nih.gov/compound/25423 — تاريخ الاطلاع: 18 نوفمبر 2016 — العنوان : CHLORAMINE — الرخصة: محتوى حر
- معرف بوب كيم: https://pubchem.ncbi.nlm.nih.gov/compound/25423
- Chambers, Michael. "ChemIDplus - 10599-90-3 - QDHHCQZDFGDHMP-UHFFFAOYSA-N - Chloramine - Similar structures search, synonyms, formulas, resource links, and other chemical information". chem.nlm.nih.gov (باللغة الإنجليزية). مؤرشف من الأصل في 15 ديسمبر 2019. اطلع عليه بتاريخ 28 مارس 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Fair, G. M., J. C. Morris, S. L. Chang, I. Weil, and R. P. Burden. 1948. The behavior of chlorine as a water disinfectant. J. Am. Water Works Assoc. 40: 1051–1061.
- G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 477–479.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. de Gruyter, Berlin 2007, (ردمك 978-3-11-017770-1).
- Anton Hammerl; Thomas M. Klapötke (2005), "Nitrogen: Inorganic Chemistry", Encyclopedia of Inorganic Chemistry (الطبعة 2nd), Wiley, صفحات 55–58 الوسيط
|CitationClass=تم تجاهله (مساعدة); الوسيط|separator=تم تجاهله (مساعدة)CS1 maint: ref=harv (link) - Jacangelo, J. G., V. P. Olivieri, and K. Kawata. 1987. Oxidation of sulfhydryl groups by monochloramine. Water Res. 21:1339–1344.
- Morris, J. C. 1966. Future of chlorination. J. Am. Water Works Assoc. 58:1475–1482.
- بوابة الكيمياء
 صور وملفات صوتية من كومنز
صور وملفات صوتية من كومنز